网址:http://m.1010jiajiao.com/timu3_id_35489[举报]
S2Cl2是一种金黄色易挥发的液体(熔点:-76℃,沸点:138℃),易水解,常用作橡胶硫化剂,改变生橡胶受热发粘、遇冷变硬的性质。向熔融的硫中通以干燥、纯净的C12即可生成S2C12。下图是实验室制备S2Cl2的装置(夹持装置、加热装置均已略去)。
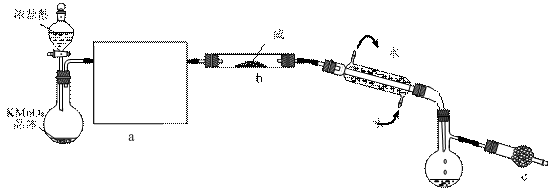
请回答下列问题:
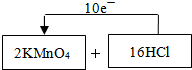
⑴制取氯气的化学反应方程式(未配平)为:KMnO4 +HCl(浓)—MnCl2 + KCl+ Cl2↑+H2O,请将氧化剂和还原剂的化学式及其配平后的系数填入下列方框中,并标出电子转移的方![]() 向和数目:
向和数目:
+ ![]()
⑵开始实验,打开分液漏斗的活塞,发现浓盐酸流出少量后即难以下滴,经检查分液漏斗活塞没有堵塞,你认为应采取的措施是 ▲ 。
⑶①在方框a中画出所缺装置图,并注明相关试剂的名称。
②图中c装置中应放置的试剂为碱石灰,其作用为 ▲ 。
⑷某同学通过查阅资料发现:实验室常利用软锰矿(主要成分为MnO2和一些不溶性杂质)制取KMnO4晶体,其反应原理如下:
3MnO2+6KOH+KClO3 ![]() 3K2MnO4+KCl+3H2O
3K2MnO4+KCl+3H2O
3MnO42-+4H+=2MnO4-+MnO2↓+2H2O
请设计由软锰矿制备KMnO4晶体的实验步骤:① ▲ ;② ▲ ;③ ▲ ;④ ▲ 。
查看习题详情和答案>>实验室制Cl2有如下几步操作:
① 在烧瓶内装入MnO2粉末;
② 塞好带导管和分液漏斗的双孔塞;
③ 由分液漏斗向烧瓶中注入浓盐酸;
④ 用铁夹固定圆底烧瓶;
⑤ 检查装置气密性;
⑥ 放好酒精灯;
⑦ 点燃酒精灯;
⑧ 放好铁圈和石棉网。
正确的操作顺序是( )
A.①、②、③、⑤、⑧、④、⑥、⑦ B.⑤、①、②、③、⑧、④、⑥、⑦
C.⑤、⑥、⑧、①、②、③、④、⑦ D.⑥、⑧、⑤、①、②、③、④、⑦
查看习题详情和答案>>
① 在烧瓶内装入MnO2粉末;
② 塞好带导管和分液漏斗的双孔塞;
③ 由分液漏斗向烧瓶中注入浓盐酸;
④ 用铁夹固定圆底烧瓶;
⑤ 检查装置气密性;
⑥ 放好酒精灯;
⑦ 点燃酒精灯;
⑧ 放好铁圈和石棉网。
正确的操作顺序是( )
A.①、②、③、⑤、⑧、④、⑥、⑦ B.⑤、①、②、③、⑧、④、⑥、⑦
C.⑤、⑥、⑧、①、②、③、④、⑦ D.⑥、⑧、④、②、⑤、①、③、⑦
查看习题详情和答案>>
① 在烧瓶内装入MnO2粉末;
② 塞好带导管和分液漏斗的双孔塞;
③ 由分液漏斗向烧瓶中注入浓盐酸;
④ 用铁夹固定圆底烧瓶;
⑤ 检查装置气密性;
⑥ 放好酒精灯;
⑦ 点燃酒精灯;
⑧ 放好铁圈和石棉网。
正确的操作顺序是( )
A.①、②、③、⑤、⑧、④、⑥、⑦ B.⑤、①、②、③、⑧、④、⑥、⑦
C.⑤、⑥、⑧、①、②、③、④、⑦ D.⑥、⑧、⑤、①、②、③、④、⑦
查看习题详情和答案>>
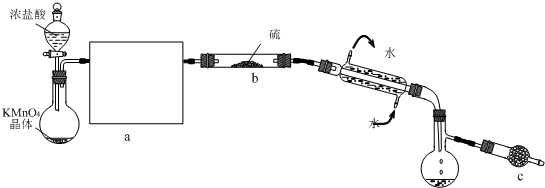
请回答下列问题:
(1)制取氯气的化学反应方程式(未配平)为:KMnO4+HCl(浓)-MnCl2+KCl+Cl2↑+H2O,请将氧化剂和还原剂的化学式及其配平后的系数填入下列空格中,并标出电子转移的方向和数目:

(2)开始实验,打开分液漏斗的活塞,发现浓盐酸流出少量后即难以下滴,经检查分液漏斗活塞没有堵塞,你认为应采取的措施是
(3)①在方框a中画出所缺装置图,并注明相关试剂的名称.
②图中c装置中应放置的试剂为碱石灰,其作用为
(4)某同学通过查阅资料发现:实验室常利用软锰矿(主要成分为MnO2和一些不溶性杂质)制取KMnO4晶体,其反应原理如下:
3MnO2+6KOH+KClO3
| ||
3MnO42-+4H+=2MnO4-+MnO2↓+2H2O
请设计由软锰矿制备KMnO4晶体的实验步骤:①