摘要:16.如图所示为相互串连的甲.乙两电解池.试回答: ⑴甲池若为用电解原理精炼铜的装置. A是 极.是 材料.电极反应是 . B是 极.是 材料.电极反应是 . 电解质溶液为 . ⑵乙池中若滴入少量酚酞试液.开始电解一段时间. Fe极附近呈 色. ⑶若甲槽阴极增重12.8 g.则乙槽阳极放出气体在标准 状况下的体积为 . ⑷若乙槽剩余液体为400 mL.则电解后得到碱液的物质的量浓度为 .pH为 .
网址:http://m.1010jiajiao.com/timu3_id_354515[举报]
如图所示为相互串联的甲、乙两个电解池,试回答:
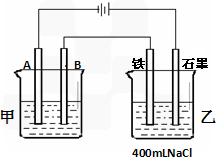
(1)若甲池利用电解原理在铁上镀银,则A极的电极材料为__________,应选用的电解质溶液是_____________,B极的电极反应式为____________。
(2)乙池中若滴入少量酚酞试液,开始电解一段时间,电极附近呈红色的是_______极。(填“铁”或“石墨”)
(3)若甲池阴极质量变化为43.2克,则乙槽中阳极上放出的气体在标况下的体积是_______ml。忽略乙槽中溶液体积的变化,则电解后所得溶液的物质的量浓度为________, 其pH值等于___________.(不考虑气体在水中的溶解)。
查看习题详情和答案>>
(2)乙池中若滴入少量酚酞试液,开始电解一段时间,电极附近呈红色的是_______极。(填“铁”或“石墨”)
(3)若甲池阴极质量变化为43.2克,则乙槽中阳极上放出的气体在标况下的体积是_______ml。忽略乙槽中溶液体积的变化,则电解后所得溶液的物质的量浓度为________, 其pH值等于___________.(不考虑气体在水中的溶解)。
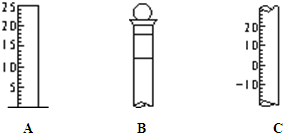 如图所示为常见仪器的部分结构.
如图所示为常见仪器的部分结构.(1)请写出下列仪器的名称:A
量筒
量筒
,B容量瓶
容量瓶
,C温度计
温度计
.(2)仪器B上标记有
②③⑤
②③⑤
(填序号).①质量 ②温度 ③刻度线 ④浓度 ⑤容积.
如图所示为实验室常用的仪器:
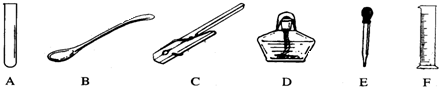
请根据图回答:
(1)写出A~F各仪器的名称:
A B C D E F
(2)用于吸取和滴加少量液体的是(填序号,下同) ;
(3)能直接加热的仪器是 ;
(4)用于作热源的仪器是 ;
(5)用于夹持试管的是 ;
(6)可取用少量固体粉未的是 ;
(7)用来量取液体体积的是 .
查看习题详情和答案>>

请根据图回答:
(1)写出A~F各仪器的名称:
A
(2)用于吸取和滴加少量液体的是(填序号,下同)
(3)能直接加热的仪器是
(4)用于作热源的仪器是
(5)用于夹持试管的是
(6)可取用少量固体粉未的是
(7)用来量取液体体积的是
(1)如图所示为常见仪器的部分结构(有的仪器被放大) 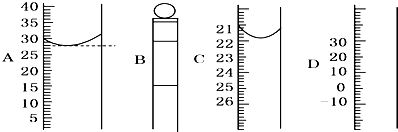
D的仪器名称是 、A图中液面所示溶液的体积为 mL,C图中的液面与“0”刻度之间的体积差为 mL.(设A、C中分别盛有无色溶液).
(2)某烧碱样品中含有少量不与酸作用的可溶性杂质,为了测定其纯度,进行以下滴定操作:
A.在容量瓶中配制A mL烧碱溶液
B.用移液管(或碱式滴定管)量取<“m“:math dsi:zoomscale=150 dsi:_mathzoomed=1>110
×A mL烧碱溶液于锥形瓶中并加几滴酚酞指示剂
C.在天平上准确称取烧碱样品wg,在烧杯中加蒸馏水溶解
D.将物质的量浓度为m mol/L的标准盐酸溶液装入酸式滴定管,调整液面,记下开始刻度V1 mL
E.滴定到终点,记录终点刻度为V2 mL
请完成下列问题:
①正确的操作步骤是(填写字母) → → →D→ .
②操作中眼睛要注视 .
③滴定终点的判断 .
④若酸式滴定管没用标准盐酸润洗,会对测定结果有何影响 (填“偏高”、“偏低”或“无影响”,其他操作均正确).
⑤该烧碱样品的纯度计算式是 .
查看习题详情和答案>>

D的仪器名称是
(2)某烧碱样品中含有少量不与酸作用的可溶性杂质,为了测定其纯度,进行以下滴定操作:
A.在容量瓶中配制A mL烧碱溶液
B.用移液管(或碱式滴定管)量取<“m“:math dsi:zoomscale=150 dsi:_mathzoomed=1>110
| 1 | 10 |
C.在天平上准确称取烧碱样品wg,在烧杯中加蒸馏水溶解
D.将物质的量浓度为m mol/L的标准盐酸溶液装入酸式滴定管,调整液面,记下开始刻度V1 mL
E.滴定到终点,记录终点刻度为V2 mL
请完成下列问题:
①正确的操作步骤是(填写字母)
②操作中眼睛要注视
③滴定终点的判断
④若酸式滴定管没用标准盐酸润洗,会对测定结果有何影响
⑤该烧碱样品的纯度计算式是
 Ⅰ.如图所示为常见仪器的部分结构.
Ⅰ.如图所示为常见仪器的部分结构.(1)请写出下列仪器的名称:A
量筒
量筒
,B容量瓶
容量瓶
,C温度计
温度计
.(2)仪器B上标记有
②③⑤
②③⑤
(填序号).①质量 ②温度 ③刻度线 ④浓度 ⑤容积
(3)仪器B使用前必须
检查是否漏水
检查是否漏水
.Ⅱ.现用98%的浓H2SO4(密度为1.84g/cm3)来配制480mL0.2mol/L的稀H2SO4.
有关操作为:①计算所需浓硫酸的体积 ②量取一定体积的浓硫酸 ③稀释、冷却 ④转移、洗涤 ⑤定容 ⑥摇匀
回答下列问题
(4)应量取的浓硫酸体积是
5.4mL
5.4mL
,实验中所用的玻璃仪器除烧杯、玻璃棒、量筒、胶头滴管外还有500mL容量瓶
500mL容量瓶
;(5)第③步中稀释浓硫酸的操作是
将浓硫酸沿烧杯内壁慢慢加入水中,边加边用玻璃棒搅拌
将浓硫酸沿烧杯内壁慢慢加入水中,边加边用玻璃棒搅拌
(6)将所配制的稀H2SO4进行测定,发现实际浓度大于0.2mol/L.请你分析下列哪些操作会引起所配浓度偏大(填写字母)
ACF
ACF
.A.用量筒量取浓硫酸时,仰视量筒的刻度
B.容量瓶未干燥即用来配制溶液
C.浓硫酸在烧杯中稀释后,未冷却就立即转移到容量瓶中,并进行定容
D.往容量瓶转移时,有少量液体溅出
E.烧杯未进行洗涤
F.在容量瓶中定容时俯视容量瓶刻度线
G.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线.