摘要:现有A.B两种气体.可能是H2.CO.NH3.HCl.SO2中的两种.若将A.B混合通入水中.A过量时生成物为C.B过量时则生成物为D.C和D的晶体加热都有A和B产生.加热D晶体时还有无色无味的液体E生成. 试推断A.B.C.D.E为何物质.A B C D E .
网址:http://m.1010jiajiao.com/timu3_id_354475[举报]
现有A、B、C、D、E五种元素,它们的质子数依次增多.
①A的核电荷数大于2,可形成氢化物H2A,该氢化物在常温下是液体;
②A和B两元素可形成B2A3化合物,该化合物既能溶于强酸,又能溶于强碱;
③C+离子比B3+离子多8个电子;
④C与D元素可以形成化合物CD;
⑤CD的溶液中通入氯气后加淀粉溶液显蓝色;
⑥E、C同主族,且E比C多两个电子层,E单质可与冷水反应生成氢气.
试回答:
(1)写出元素C、E的名称:C
(2)画出A的原子结构示意图
 ,B的离子结构示意图
,B的离子结构示意图
 ,D的单质分子的电子式
,D的单质分子的电子式
 .
.
(3)写出B2A3分别与盐酸和氢氧化钠溶液反应的离子方程式:
(4)比较B、C、E三种元素形成的简单离子半径的大小和氧化性的强弱(用离子符号表示):离子半径:
(5)写出E与冷水反应的化学方程式:
查看习题详情和答案>>
①A的核电荷数大于2,可形成氢化物H2A,该氢化物在常温下是液体;
②A和B两元素可形成B2A3化合物,该化合物既能溶于强酸,又能溶于强碱;
③C+离子比B3+离子多8个电子;
④C与D元素可以形成化合物CD;
⑤CD的溶液中通入氯气后加淀粉溶液显蓝色;
⑥E、C同主族,且E比C多两个电子层,E单质可与冷水反应生成氢气.
试回答:
(1)写出元素C、E的名称:C
钾
钾
;E铯
铯
.(2)画出A的原子结构示意图






(3)写出B2A3分别与盐酸和氢氧化钠溶液反应的离子方程式:
Al2O3+6H+=2Al3++3H2O
Al2O3+6H+=2Al3++3H2O
;Al2O3+2OH-=2AlO2-+H2O
Al2O3+2OH-=2AlO2-+H2O
.(4)比较B、C、E三种元素形成的简单离子半径的大小和氧化性的强弱(用离子符号表示):离子半径:
Cs+>K+>Al3+
Cs+>K+>Al3+
;氧化性:Al3+>K+>Cs+
Al3+>K+>Cs+
.(5)写出E与冷水反应的化学方程式:
2Cs+2H2O=2CsOH+H2↑
2Cs+2H2O=2CsOH+H2↑
.(1)现有A、B、C、D、E五种元素,A的原子核中没有中子;B、C元素处于同一周期,C的原子半径较小,B、C的质子数之和为27,质子数之差为5;5.4 g D的单质跟足量盐酸反应,生成D3+和6.72 L(标准状况)氢气;E和C能形成E2C型离子化合物,且E、C两元素的简单离子具有相同电子层结构.
①写出元素符号:
A________,C________,E________.
②B、D的最高价氧化物对应水化物相互反应的离子方程式为:________.
③用电子式表示C与E形成E2C的过程:________.
(2)元素在周期表中的位置,反映了元素的原子结构和元素的性质.下图是元素周期表的一部分.
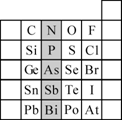
①根据元素周期律,预测:酸性强弱H3AsO4________H3PO4.(用“>”或“<”表示)
②元素S的最高正价和最低负价的代数和为________,在一定条件下,S与H2反应有一定限度(可理解为反应进行的程度),请判断:在相同条件下Se与H2反应的限度比S与H2反应限度________.(选填“更大”、“更小”或“相同”)
③Br2具有较强的氧化性,SO2具有较强的还原性,将SO2气体通入溴水后,溶液中存在的主要离子是________.
 A、B、C、D都是中学化学中常见物质,其中A、B、C均含有同一种元素,在一定条件下相互转化关系如右(部分反应中的水已略去).
A、B、C、D都是中学化学中常见物质,其中A、B、C均含有同一种元素,在一定条件下相互转化关系如右(部分反应中的水已略去).(1)若A为氯碱工业的产品,C为厨房中的用品.
①D的电子式是


②反应Ⅲ的离子方程式是
HCO3-+OH-=H2O+CO32-
HCO3-+OH-=H2O+CO32-
.③氯碱工业制备A的化学方程式是
2NaCl+2H2
2NaOH+H2↑+Cl2↑
| ||
2NaCl+2H2
2NaOH+H2↑+Cl2↑
,其中两种产物可与KI溶液反应制得一种化工原料,若消耗0.1mol KI转移电子0.6mol,则三种物质间反应的离子方程式是
| ||
3Cl2+6OH-+I-=6Cl-+IO3-+3H2O
3Cl2+6OH-+I-=6Cl-+IO3-+3H2O
.(2)若A、D均为单质,且A为气体,D元素的一种红棕色氧化物常用作颜料.
①反应Ⅲ的离子方程式是
Cl2+2Fe2+=2Cl-+2Fe3+
Cl2+2Fe2+=2Cl-+2Fe3+
.②B可作净水剂,在使用时发现B不能使酸性废水中的悬浮物沉降除去,其原因是
Fe3++3H2O Fe(OH)3+3H+,酸性条件抑制了Fe3+的水解,不能生成Fe(OH)3胶体
Fe(OH)3+3H+,酸性条件抑制了Fe3+的水解,不能生成Fe(OH)3胶体
 Fe(OH)3+3H+,酸性条件抑制了Fe3+的水解,不能生成Fe(OH)3胶体
Fe(OH)3+3H+,酸性条件抑制了Fe3+的水解,不能生成Fe(OH)3胶体Fe3++3H2O Fe(OH)3+3H+,酸性条件抑制了Fe3+的水解,不能生成Fe(OH)3胶体
Fe(OH)3+3H+,酸性条件抑制了Fe3+的水解,不能生成Fe(OH)3胶体
. Fe(OH)3+3H+,酸性条件抑制了Fe3+的水解,不能生成Fe(OH)3胶体
Fe(OH)3+3H+,酸性条件抑制了Fe3+的水解,不能生成Fe(OH)3胶体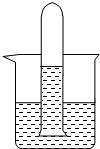 A、B、C为三种常见的单质,其中A、C为气体,B为常见金属.A溶于水所得的溶液可使石蕊试液先变红后退色.F的水溶液为浅绿色溶液,它们的关系如图:
A、B、C为三种常见的单质,其中A、C为气体,B为常见金属.A溶于水所得的溶液可使石蕊试液先变红后退色.F的水溶液为浅绿色溶液,它们的关系如图:
(1)写出A、B、D的化学式:
A.
Cl2
Cl2
B.Fe
Fe
D.FeCl3
FeCl3
(2)写出反应①②的离子方程式
①
Fe+2H+═Fe2++H2↑
Fe+2H+═Fe2++H2↑
②
2Fe2++Cl2═2Fe3++2Cl-
2Fe2++Cl2═2Fe3++2Cl-
(3)检验D的水溶液中的阳离子的方法是:
取少量溶液于试管中,滴加两滴KSCN溶液,观察溶液是否变红色
取少量溶液于试管中,滴加两滴KSCN溶液,观察溶液是否变红色
.将D溶液逐滴加入的沸水中会产生一种红褐色的澄清液体.有同学认为该液体中的分散质粒子直径应该在1nm~100nm之间,验证这一想法的简单方法是:是否有丁达尔现象
是否有丁达尔现象
(4)如图某同学将A的饱和溶液装满大试管倒置于烧杯中,光照一段时间后,发现试管底部有无色的气体产生,溶液的颜色也变成无色,请你帮他对产生的气体进行探究:
a.你预测气体可能是
O2
O2
、或H2
或H2
b.针对你的预测写出验证实验方案:
在水下堵住试管口,取出正放,用燃着的木条放在试管口,如果气体燃烧说明是H2;如果木条燃烧更旺说明是O2
在水下堵住试管口,取出正放,用燃着的木条放在试管口,如果气体燃烧说明是H2;如果木条燃烧更旺说明是O2
.
H2、CO、CO2和CH4都是中学化学常见的气体.
(1)可燃性气体与空气混合点燃可能会爆炸,所以可燃性气体点燃前应先 .
(2)某无色气体X可能含有上述4种气体中的一种或两种.为了确认气体X的组成,同学们按如图装置进行实验.(气体燃烧装置中能提供足量的氧气保证可燃性气体充分燃烧)
小资料:碱石灰的主要成分是CaO和NaOH,能吸收CO2和水蒸气.
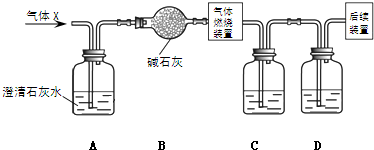
①装置A的作用是 装置B的作用是 .
②装置C盛放的试剂是 (填序号),D中盛放的试剂是 (填序号).
a.烧碱溶液 b.浓硫酸
③若取1.6g气体X进行实验(假设每步反应都完全),发现装置A中无明显变化,装置C增重1.8g,装置D增重2.2g.通过计算回答:燃烧生成CO2 mol,H2O mol
说明1.6g气体X中含有碳元素 g,含有氢元素 g.是否含有氧元素? (填“是”或“否”).在标准状况下1.6g气体X所占的体积为 L;气体X的相对分子质量(若为单一气体)或平均相对分子质量(若为混合气体)为 (小数点后保留2位)
查看习题详情和答案>>
(1)可燃性气体与空气混合点燃可能会爆炸,所以可燃性气体点燃前应先
(2)某无色气体X可能含有上述4种气体中的一种或两种.为了确认气体X的组成,同学们按如图装置进行实验.(气体燃烧装置中能提供足量的氧气保证可燃性气体充分燃烧)
小资料:碱石灰的主要成分是CaO和NaOH,能吸收CO2和水蒸气.

①装置A的作用是
②装置C盛放的试剂是
a.烧碱溶液 b.浓硫酸
③若取1.6g气体X进行实验(假设每步反应都完全),发现装置A中无明显变化,装置C增重1.8g,装置D增重2.2g.通过计算回答:燃烧生成CO2
说明1.6g气体X中含有碳元素