摘要:计算题 例1 取0.45molNaOH.0.35molNa2CO3和0.2molNaHCO3溶于水.在混合溶液中逐滴加入盐酸.仅应明显地分三个阶段进行.设加入盐酸的物质的量为nmol.溶液中随盐酸的加入.NaCl.Na2CO3.NaHCO3的物质的量分别xmol.ymol.zmol.试求X=f的函数关系.并作出相应的函数图象. 解析 NaHCO3 + NaOH = Na2CO3 + H2O 0.2mol 0.2mol 0.2mol 混合反应后Na2CO30.55mol.NaOH0.25mol 逐滴加盐酸时.三步反应及其物质的量之间的关系如下: ①NaOH+HCl=NaCl+H2O 0.25 0.25 0.25 ②Na2CO3+HCl=NaCl+NaHCO3 0.55 0.55 0.55 0.55 ③NaHCO3+HCl=NaCl+CO2↑+H2O 0.55 0.55 0.55 各步反应消耗盐酸总量的临界值分别为0.25mol.0.8mol.1.35mol . 当0<n≤1.35时.加入HCl的物质的量即NaCl物质的量.x=n 当n>1.35时.HCl过量.x=1.35 故x=f(n)的函数表达式为: x= n 1.35 图象: ①当0<n≤0.25时.HCl仅与NaOH反应. y=0.55.z=0 ②当0.25<n≤0.8时.开始第二步反应.生成NaHCO3. =.y=0.8-n =.z=n-0.25 ③0.8<n≤1.35时.发生第三步反应 y=0 =.z=1.35-n ④当n>1.35时.第三步反应也已完全 y=0.z=0. 故有 z= y= 0.55 0 0.8-n n-0.25 0 1.35-n 图象为: 例2 氨氧化法可制得50%的HNO3.加脱水剂可进一步制备90%的HNO3.两种产品的质量比=x(m1.m2分别为50%.90%的HNO3溶液的质量.若以17t液氨为原料生产硝酸.试求: 与质量比x的关系式(假定NH3转化率为100%) (2)求出只生产50%的硝酸所需水量和只生产90%的硝酸所出水量 (3)当x为何值时.进出水量保持平衡.此时两种产品的总质量为多少吨? 解析 首先请思考这样一个问题: 将一定量的NH3完全氧化成HNO3全部溶解在反应生成的水中.这种硝酸溶液溶质的质量分数是多少? 该反应过程相当复杂.但可通过守恒写出总方程式 NH3+2O2=HNO3+H2O 63 18 HNO3%=×100%=77.8% 当浓度为50%<77.8%.需加水. 当浓度为90%>77.8%.需出水. 由上关系式计.17tNH3制63tHNO3 m1:m2=x 50%m1+90%m2=63 m2= --① 理论所需水量=两种溶液中实际含水量-反应中生成的水量 y=(50%m1+10%m2)-18 =63-90%m2+10%m2-18 =45-80%m2 --② ①代入②得 y=45- (2)只生产50%的HNO3.则m2=0.x→+∞. y=45.即需加水45t 只生产90%的HNO3.则m1=0.x=0 y=45-=45-56=-11 即需去水11t. (3)进出水量平衡.即 y=0.则45-=0 x= 此时两种产品总质量即为反应生成的HNO3和水的质量之和. 即63+18=81(t) △ 例3 NH4HCO3和Ca(OH)2共热时可能发生如下反应: △ NH4HCO3+Ca(OH)2=CaCO3+NH3↑+2H2O --(1) NH4HCO3=NH3↑+CO2↑+H2O --(2) 在密闭容器中加热碳酸氢铵和熟石灰的混合物共0.1mol.充分反应后得固体剩余物ag或以b(mol)表示混合物中NH4HCO3的物质的量.试通过计算确定b在不同的取值范围时.a值随b值变化的函数表达式. 解 (1)当NH4HCO3和Ca(OH)2以等物质的量相混合时.二者恰好完全反应.生成的固体只有CaCO3.a=0.05×100=5(g) (2)当0<b<0.05时.NH4HCO3全部参加反应2有剩余.所得固体有两种: m总=mCaCO3+mCa(OH)2=100b+ ×74 =g (3)当0.05<b<0.1时.NH4HCO3在反应(1)有剩余.但又能发生反应无固体残留.故所得固体只有CaCO3(1-b)mol a=100(1-b)g 例4 将总量为4mol的Na2O2和Al2(SO4)3混合物投入到足量水中.充分反应后生成ymol沉淀.若以x表示原混合物Na2O2的物质的量.试建立y=f(x)的函数关系式.将x取值和y=f(x)的关系式填在下表内并作图. x值 y=f(x) 解析 分两个阶段: ①沉淀开始生成至沉淀完全 ②沉淀开始溶解至完全消失 先分析化学反应量的关系.令Na2O2xmol.则Al2(SO4)3为(4-x)mol Na2O2-2NaOH-2OH- x 2x Al2(SO4)3-2Al3+ 4-x 2(4-x) 后求出几个关键点 (1)当x=0.y=0 3沉淀最大值 Al3+-3OH--Al(OH)3 1 3 1 x=3mol y=2mol 2(4-x) 2x y =, 3完全溶解时 Al3+-4OH- 1 4 2(4-x) 2x = x=3.2mol.y=0 最终函数方程可用解析法求解. 直线OA的斜率: R==.截距b=0 y=kx=x 直线AB的斜率: k====-10 y-y0=k(x-x0) y-0=-10 y=32-10x x值 y=f(x) 0<x<3 y=x x=3 y=2 3.2>x>3 y=32-10x 小结 函数型的计算题处理要点: (1)找出变量x的取值范围.一般可根据临界反应确定临界点.然后分各区间依次取值讨论. (2)根据化学计量关系来确定因变量y与x的关系. (3)若为线性关系.可借用数学方法处理.
网址:http://m.1010jiajiao.com/timu3_id_354433[举报]
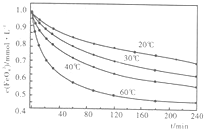 (2010?安徽模拟)高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝、杀菌、灭菌、去浊、脱色、除臭为一体的新型、高效、绿色环保的多功能水处理剂.近十几年来,我国对高铁酸钾在饮用水处理中的应用的研究也不断深入,已取得可喜成果.比较理想的制备方法是次氯酸盐氧化法:先向KOH溶液中通入足量Cl2制备次氯酸钾饱和溶液,再分次加入KOH固体,得到次氯酸钾强碱性饱和溶液,加入三价铁盐,合成高铁酸钾.
(2010?安徽模拟)高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝、杀菌、灭菌、去浊、脱色、除臭为一体的新型、高效、绿色环保的多功能水处理剂.近十几年来,我国对高铁酸钾在饮用水处理中的应用的研究也不断深入,已取得可喜成果.比较理想的制备方法是次氯酸盐氧化法:先向KOH溶液中通入足量Cl2制备次氯酸钾饱和溶液,再分次加入KOH固体,得到次氯酸钾强碱性饱和溶液,加入三价铁盐,合成高铁酸钾.(1)向次氯酸钾强碱饱和溶液中加入三价铁盐发生反应的离子方程式:
①Fe3++3OH-=Fe(OH);②
2Fe(OH)3+3ClO-+10OH-=2FeO2-4+3Cl-+5H2O
2Fe(OH)3+3ClO-+10OH-=2FeO2-4+3Cl-+5H2O
.(2)高铁酸钾溶于水能释放大量的原子氧,从而非常有效地杀灭水中的病菌和病毒,与此同时,自身被还原成新生态的Fe(OH)3,这是一种品质优良的无机絮凝剂,能高效地除去水中的微细悬浮物.将适量K2Fe2O4溶液于pH=4.74的溶液中,配制成c(FeO2-4)=1.0mmol?L-1试样,将试样分别置于20℃、30℃、40℃和60℃的恒温水浴中,测定c(FeO+2-4)的变化,结果见图.高铁酸钾与水反应的离子反应方程式为
4FeO2-4+10H2O=4Fe(OH)3+8OH-+3O2↑
4FeO2-4+10H2O=4Fe(OH)3+8OH-+3O2↑
,该反应的△H>
>
0(填“>”“<”或“=”).(3)高铁酸盐还是一类环保型高性能电池的材料,用它做成的电池能量高,放电电流大,能长时间保持稳定的放电电压.高铁电池的总反应为:3Zn+2K2FeO4+8H2O
| 放电 |
| 充电 |
Zn+2OH--2e-=Zn(OH)
Zn+2OH--2e-=Zn(OH)
,若外电路有5.418×1022个电子通过,则正极有5.94
5.94
g高铁酸钾参与反应.(4)测定某K2FeO4溶液浓度的实验步骤如下:
步骤1:准确量取V mL K2FeO4溶液加入到锥形瓶中
步骤2:在强碱性溶液中,用过量CrO-2与FeO2-4反应生成Fe(OH)3和CrO2-4
步骤3:加足量稀硫酸,使CrO2-4转化为Cr2O2-7,CrO-2转化为Cr3+,Fe(OH)3转化为Fe2+
步骤4:加入二苯胺磺酸钠作指示剂,用c mol?L-1(NH4)2Fe(SO4)2标准溶液滴定至终点,消耗(NH4)2Fe(SO4)2溶液V1mL.
①滴定时发生反应的离子方程式为
6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O
6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O
.②原溶液中K2FeO4的浓度为
| cV1 |
| 3V |
| cV1 |
| 3V |
 不同浓度的硫酸与锌反应时,硫酸可以被还原为SO2,也可被还原为氢气.为了验证这一事实,某同学拟用如图装置进行实验(实验时压强为10lkPa,温度为0℃,锌的相对原子质量为65).
不同浓度的硫酸与锌反应时,硫酸可以被还原为SO2,也可被还原为氢气.为了验证这一事实,某同学拟用如图装置进行实验(实验时压强为10lkPa,温度为0℃,锌的相对原子质量为65).(1)若在烧瓶中放入1.30g锌粒,与c mol/L H2SO4反应,为保证实验结论的可靠,量气管的适宜规格是
C
C
.A、200mL B、400mL C、500mL
(2)若1.30g锌粒完全溶解,氢氧化钠洗气瓶增重l.28g,则圆底烧瓶中发生反应的化学方程式为:
Zn+2H2SO4(浓)=ZnSO4+SO2↑+2H2O
Zn+2H2SO4(浓)=ZnSO4+SO2↑+2H2O
.(3)若烧瓶中投入a g锌且完全反应,氢氧化钠洗气瓶增重b g.量气瓶中收集到Vml气体,则有:ag/65g?mol-1=bg/64g?mol-1+V ml/22400ml?mol-1,依据的原理是
得失电子守恒
得失电子守恒
.(4)若在烧瓶中投入d g锌,加入一定量的c mol/L 浓硫酸V L,充分反应后锌有剩余,测得氢氧化钠洗气瓶增重mg,则整个实验过程产生的气体中,
| n(H2) |
| n(SO2) |
| 64CV-2m |
| m |
| 64CV-2m |
| m |
| n(H2) |
| n(SO2) |
偏小
偏小
(填偏大、偏小或无影响)(5)反应结束后,为了准确地测量气体体积,量气管在读数时应注意(至少写出两条):①
待冷却至室温才开始读数
待冷却至室温才开始读数
②眼睛视线与液面最低处相平
眼睛视线与液面最低处相平
.PCl3可用于半导体生产的外延、扩散工序.有关物质的部分性质如下:
(一)制备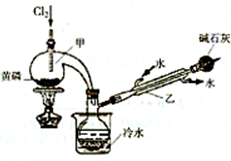
如图是实验室制备PCl3的装置(部分仪器已省略)
(1)仪器乙的名称
(2)实验室制备Cl2的离子方程式:
(3)碱石灰的作用是
(4)向仪器甲中通入干燥Cl2之前,应先通入一段时间的CO2,其目的是
(二)提纯
粗产品中常含有POCl3、PCl5等.加入黄磷加热除去PCl5后,通过
(三)分析
测定产品中PCl3纯度的方法如下:迅速称取m,g产品,水解完全后配成500mL溶液,取出25.00mL加入过量的c1mol?L-lV1mL碘溶液,充分反应后再用c2mol?L-1Na2S2O3溶液滴定过量的碘,终点时消耗V2mLNa2S2O3溶液.
已知:H3PO3+H2O+I2=H3PO4+2HI;I2+2Na2S2O3=2NaI+Na2S4O6;假设测定过程中没有其他反应.根据上述数据,该产品中PCl3的质量分数为
×100%
×100%(用含字母的代数式表示、不必化简)
查看习题详情和答案>>
| 熔点/℃ | 沸点/℃ | 密度/g?mL | 其他 | |||||||||
| 黄磷 | 44.1 | 280.5 | 1.82 | 2P(过量)+3Cl2
2P+5Cl2(过量)
| ||||||||
| PCl3 | -112 | 75.5 | 1.574 | 遇水生成H3PO3和HCl,遇O2生成POCl3 | ||||||||
| POCl3 | 2 | 105.3 | 1.675 | 遇水生成H3PO4和HCl,能溶于 PCl3 |

如图是实验室制备PCl3的装置(部分仪器已省略)
(1)仪器乙的名称
冷凝管
冷凝管
;(2)实验室制备Cl2的离子方程式:
MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O
| ||
MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O
;
| ||
(3)碱石灰的作用是
吸收多余的氯气,防止污染环境
吸收多余的氯气,防止污染环境
,防止空气中的水分进入影响产品
防止空气中的水分进入影响产品
;(4)向仪器甲中通入干燥Cl2之前,应先通入一段时间的CO2,其目的是
排净装置中的空气,防止空气中的水分和氧气与PCl3反应
排净装置中的空气,防止空气中的水分和氧气与PCl3反应
.(二)提纯
粗产品中常含有POCl3、PCl5等.加入黄磷加热除去PCl5后,通过
蒸馏
蒸馏
(填实验操作名称),即可得到PCl3的纯品.(三)分析
测定产品中PCl3纯度的方法如下:迅速称取m,g产品,水解完全后配成500mL溶液,取出25.00mL加入过量的c1mol?L-lV1mL碘溶液,充分反应后再用c2mol?L-1Na2S2O3溶液滴定过量的碘,终点时消耗V2mLNa2S2O3溶液.
已知:H3PO3+H2O+I2=H3PO4+2HI;I2+2Na2S2O3=2NaI+Na2S4O6;假设测定过程中没有其他反应.根据上述数据,该产品中PCl3的质量分数为
(c1V1-
| ||
| m |
(c1V1-
| ||
| m |
(2013?临沂一模)二氧化硫是重要的工业原料,探究其制备方法和性质具有非常重要的意义.
(1)工业上用黄铁矿(FeS2,其中S元素为-l价)在高温下和氧气反应制备SO2:4FeS2+11O2
8SO2+2Fe2O3,该反应中被氧化的元素是
(2)实验室中用如图1所示的装置测定SO2催化氧化为SO3,的转化率.(已知SO3熔点为16.8℃,假设气体进入装置时分别被完全吸收,且忽略空气中CO2的影响.)
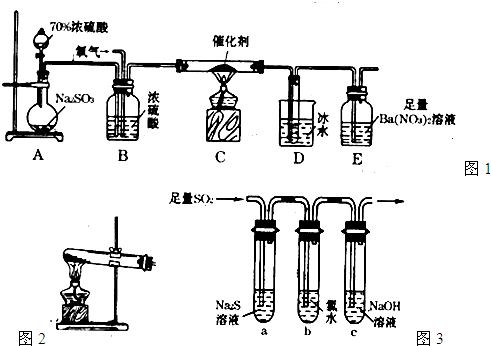
①简述使用分液漏斗向圆底烧瓶中滴加浓硫酸的操作是
②实验过程中,需要通入氧气.试写出一个用图2所示装置制取氧气的化学方程式
③当停止通入SO2,熄灭酒精灯后,需要继续通一段时间的氧气,其目的是
④实验结束后,若装置D增加的质量为m g,装置E中产生白色沉淀的质量为n g,则此条件下二氧化硫的转化率是
×100%
×100%(用含字母的代数式表示,不用化简).
(3)某学习小组设计用如图3装置验证二氧化硫的化学性质.
①能说明二氧化硫具有氧化性的实验现象为
②为验证二氧化硫的还原性,充分反应后,取试管b中的溶液分成三份,分别进行如下实验:
方案I:向第一份溶液中加入AgNO3溶液,有白色沉淀生成
方案Ⅱ:向第二份溶液加入品红溶液,红色褪去
方案Ⅲ:向第三份溶液加入BaCl2溶液,产生白色沉淀
上述方案中合理的是
③当通入二氧化硫至试管c中溶液显中性时,该溶液中c(Na+)=
查看习题详情和答案>>
(1)工业上用黄铁矿(FeS2,其中S元素为-l价)在高温下和氧气反应制备SO2:4FeS2+11O2
| ||
Fe、S
Fe、S
(填元素符号).当该反应转移2.75mol电子时,生成的二氧化硫在标准状况下的体积为11.2
11.2
L.(2)实验室中用如图1所示的装置测定SO2催化氧化为SO3,的转化率.(已知SO3熔点为16.8℃,假设气体进入装置时分别被完全吸收,且忽略空气中CO2的影响.)

①简述使用分液漏斗向圆底烧瓶中滴加浓硫酸的操作是
打开分液漏斗上口的活塞,旋开分液漏斗的旋塞,慢慢滴加
打开分液漏斗上口的活塞,旋开分液漏斗的旋塞,慢慢滴加
.②实验过程中,需要通入氧气.试写出一个用图2所示装置制取氧气的化学方程式
2KClO3
2KCl+3O2↑
| ||
| △ |
2KClO3
2KCl+3O2↑
.
| ||
| △ |
③当停止通入SO2,熄灭酒精灯后,需要继续通一段时间的氧气,其目的是
使残留在装置中的二氧化硫和三氧化硫被充分吸收
使残留在装置中的二氧化硫和三氧化硫被充分吸收
.④实验结束后,若装置D增加的质量为m g,装置E中产生白色沉淀的质量为n g,则此条件下二氧化硫的转化率是
| ||||
|
| ||||
|
(3)某学习小组设计用如图3装置验证二氧化硫的化学性质.
①能说明二氧化硫具有氧化性的实验现象为
试管a中出现淡黄色浑浊
试管a中出现淡黄色浑浊
.②为验证二氧化硫的还原性,充分反应后,取试管b中的溶液分成三份,分别进行如下实验:
方案I:向第一份溶液中加入AgNO3溶液,有白色沉淀生成
方案Ⅱ:向第二份溶液加入品红溶液,红色褪去
方案Ⅲ:向第三份溶液加入BaCl2溶液,产生白色沉淀
上述方案中合理的是
Ⅲ
Ⅲ
(填“I”、“Ⅱ”或“Ⅲ”);试管b中发生反应的离子方程式为SO2+Cl2+2H2O=4H++SO42-+2Cl-
SO2+Cl2+2H2O=4H++SO42-+2Cl-
.③当通入二氧化硫至试管c中溶液显中性时,该溶液中c(Na+)=
2c(SO32-)+c(HSO3-)
2c(SO32-)+c(HSO3-)
(用含硫微粒浓度的代数式表示).某校活动小组用图示的装置及所给药品(图中夹持仪器已略去)探究工业制硫酸接触室中的反应,并测定此条件下二氧化硫的转化率.已知C中的浓硫酸含溶质m mol,假设气体进入C和D时分别被完全吸收,且忽略装置内空气中的CO2.
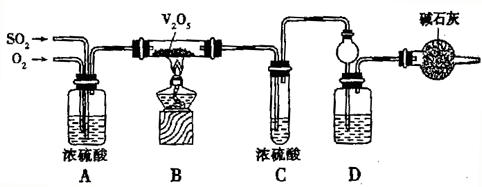
请回答下列问题:
(1)已知0.5mol SO2被O2氧化成气态SO3,放出49.15kJ热量,反应的热化学方程式为
(2)实验时装置A的作用是
①充分混合SO2和O2,②干燥作用,③通过流速控制两种气体的比例;
装置C中浓硫酸的作用为
装置D中盛放的溶液是足量的
a.BaCl2溶液 b.NaOH溶液 c.NaHSO3饱和溶液
(3)停止通入SO2,熄灭酒精灯后,为使残留在装置中的SO2、SO3被充分吸收,操作方法是
(4)实验结束,稀释装置C中的溶液,并向其中加入足量的BaCl2溶液,得到的沉淀质量为w g.若装置D增加的质量为a g,则此条件下二氧化硫的转化率是
×100%
×100%(用含字母的代数式表示,结果可不化简).
(5)以上实验方法存在一个严重的漏洞,导致转化率比实际值偏小,你认为是哪一个装置中的漏洞
A.A B.B C.C D.D
是什么漏洞?
查看习题详情和答案>>

请回答下列问题:
(1)已知0.5mol SO2被O2氧化成气态SO3,放出49.15kJ热量,反应的热化学方程式为
SO2(g)+
O2(g)?SO3(g)△H=-98.3kJ?mol-1
| 1 |
| 2 |
SO2(g)+
O2(g)?SO3(g)△H=-98.3kJ?mol-1
;| 1 |
| 2 |
(2)实验时装置A的作用是
②③
②③
,(填序号)①充分混合SO2和O2,②干燥作用,③通过流速控制两种气体的比例;
装置C中浓硫酸的作用为
吸收SO3
吸收SO3
;装置D中盛放的溶液是足量的
b
b
(填序号)a.BaCl2溶液 b.NaOH溶液 c.NaHSO3饱和溶液
(3)停止通入SO2,熄灭酒精灯后,为使残留在装置中的SO2、SO3被充分吸收,操作方法是
继续通入氧气一段时间
继续通入氧气一段时间
;(4)实验结束,稀释装置C中的溶液,并向其中加入足量的BaCl2溶液,得到的沉淀质量为w g.若装置D增加的质量为a g,则此条件下二氧化硫的转化率是
| ||||
|
| ||||
|
(5)以上实验方法存在一个严重的漏洞,导致转化率比实际值偏小,你认为是哪一个装置中的漏洞
C
C
,A.A B.B C.C D.D
是什么漏洞?
C装置中三氧化硫不一定被完全吸收
C装置中三氧化硫不一定被完全吸收
.