��Ŀ����
 ��ͬŨ�ȵ�������п��Ӧʱ��������Ա���ԭΪSO2��Ҳ�ɱ���ԭΪ������Ϊ����֤��һ��ʵ��ijͬѧ������ͼװ�ý���ʵ�飨ʵ��ʱѹǿΪ10lkPa���¶�Ϊ0�棬п�����ԭ������Ϊ65����
��ͬŨ�ȵ�������п��Ӧʱ��������Ա���ԭΪSO2��Ҳ�ɱ���ԭΪ������Ϊ����֤��һ��ʵ��ijͬѧ������ͼװ�ý���ʵ�飨ʵ��ʱѹǿΪ10lkPa���¶�Ϊ0�棬п�����ԭ������Ϊ65������1��������ƿ�з���1.30gп������c mol/L H2SO4��Ӧ��Ϊ��֤ʵ����۵Ŀɿ��������ܵ����˹����
C
C
��A��200mL ���������� B��400mL ���������� C��500mL
��2����1.30gп����ȫ�ܽ⣬��������ϴ��ƿ����l.28g����Բ����ƿ�з�����Ӧ�Ļ�ѧ����ʽΪ��
Zn+2H2SO4��Ũ��=ZnSO4+SO2��+2H2O
Zn+2H2SO4��Ũ��=ZnSO4+SO2��+2H2O
����3������ƿ��Ͷ��a gп����ȫ��Ӧ����������ϴ��ƿ����b g������ƿ���ռ���Vml���壬���У�ag/65g?mol-1=bg/64g?mol-1+V ml/22400ml?mol-1�����ݵ�ԭ����
��ʧ�����غ�
��ʧ�����غ�
����4��������ƿ��Ͷ��d gп������һ������c mol/L Ũ����V L����ַ�Ӧ��п��ʣ�࣬�����������ϴ��ƿ����mg��������ʵ����̲����������У�
| n(H2) |
| n(SO2) |
| 64CV-2m |
| m |
| 64CV-2m |
| m |
| n(H2) |
| n(SO2) |
ƫС
ƫС
����ƫ��ƫС����Ӱ�죩��5����Ӧ������Ϊ��ȷ�ز�������������������ڶ���ʱӦע�⣨����д������������
����ȴ�����²ſ�ʼ����
����ȴ�����²ſ�ʼ����
���۾�������Һ����ʹ���ƽ
�۾�������Һ����ʹ���ƽ
����������1������п�������������������������Ӷ�ȷ�������ܵ����˹��
��2�������������Ƶ����ʷ������ص�ԭ��д����Ӧ�Ļ�ѧ��Ӧ����ʽ��
��3������������ԭ��Ӧ���ص������
��4��������������ϴ��ƿ���ص��������Ӧ����������ʵ���������������ȥ���ɶ���������Ҫ�����������Ϊ��������������������̶����������������ʵ�����������ˮ�Ȼ��Ƶ����÷�����
��5���ٸ��ݻ�ѧ��Ӧ�뷴Ӧ�ȵĹ�ϵ�������ڸ�����Һ�Ķ�������������
��2�������������Ƶ����ʷ������ص�ԭ��д����Ӧ�Ļ�ѧ��Ӧ����ʽ��
��3������������ԭ��Ӧ���ص������
��4��������������ϴ��ƿ���ص��������Ӧ����������ʵ���������������ȥ���ɶ���������Ҫ�����������Ϊ��������������������̶����������������ʵ�����������ˮ�Ȼ��Ƶ����÷�����
��5���ٸ��ݻ�ѧ��Ӧ�뷴Ӧ�ȵĹ�ϵ�������ڸ�����Һ�Ķ�������������
����⣺��1��Zn+H2SO4=ZnSO4+H2��
1mol 22.4L
0.448L
0.448L=448mL
��ѡC��
��2�����������Ǽ�������������壬��������ϴ��ƿ����˵���������������ɣ���п�����ᷴӦʱ��п����ԭ����������������������ԭΪ��������Zn+2H2SO4��Ũ��=ZnSO4+SO2��+2H2O��
�ʴ�Ϊ��Zn+2H2SO4��Ũ��=ZnSO4+SO2��+2H2O��
��3������������ԭ��Ӧ�е�ʧ����������г�ʽ�ӣ�
�ʴ�Ϊ����ʧ�����غ㣮
��4��Zn+2H2SO4��Ũ��=ZnSO4+SO2��+2H2O��
2mol 1mol
mol
mol
���ɶ���������Ҫ������Ϊ
mol��
Zn+H2SO4=ZnSO4+H2��
1mol 1mol
�� CV-
��mol ��CV-
��mol
=
=
��
������ʢ����ˮ�Ȼ��Ƶ�U�ܣ���������е�ˮ������������������Һ������ϴ��ƿ�������������Լ���ʱ������������ʵ������������������������ʵ���֮��ƫС��
�ʴ�Ϊ��
������ƫС��
��5����Ϊ�÷�Ӧ�Ƿ��ȷ�Ӧ�����ŷ�Ӧ�Ľ��У���Һ���¶������ߣ����ɵ������¶ȸ��ڱ�����¶ȣ��¶ȶ����������Ӱ�죬����Ҫ����ȴ�����²ſ�ʼ�������ڶ���ʱ��������ӻ����Ӷ�����������Զ���ʱ�۾�������Һ����ʹ���ƽ��
�ʴ�Ϊ���ٴ���ȴ�����²ſ�ʼ�������ڶ���ǰʹ����������Һ����ƽ�����۾�������Һ����ʹ���ƽ��
1mol 22.4L
| 1.30g |
| 65g/mol |
0.448L=448mL
��ѡC��
��2�����������Ǽ�������������壬��������ϴ��ƿ����˵���������������ɣ���п�����ᷴӦʱ��п����ԭ����������������������ԭΪ��������Zn+2H2SO4��Ũ��=ZnSO4+SO2��+2H2O��
�ʴ�Ϊ��Zn+2H2SO4��Ũ��=ZnSO4+SO2��+2H2O��
��3������������ԭ��Ӧ�е�ʧ����������г�ʽ�ӣ�
�ʴ�Ϊ����ʧ�����غ㣮
��4��Zn+2H2SO4��Ũ��=ZnSO4+SO2��+2H2O��
2mol 1mol
| m |
| 32 |
| m |
| 64 |
���ɶ���������Ҫ������Ϊ
| m |
| 32 |
Zn+H2SO4=ZnSO4+H2��
1mol 1mol
�� CV-
| m |
| 32 |
| m |
| 32 |
| n(H2) |
| n(SO2) |
(CV-
| ||
|
| 64CV-2m |
| m |
������ʢ����ˮ�Ȼ��Ƶ�U�ܣ���������е�ˮ������������������Һ������ϴ��ƿ�������������Լ���ʱ������������ʵ������������������������ʵ���֮��ƫС��
�ʴ�Ϊ��
| 64CV-2m |
| m |
��5����Ϊ�÷�Ӧ�Ƿ��ȷ�Ӧ�����ŷ�Ӧ�Ľ��У���Һ���¶������ߣ����ɵ������¶ȸ��ڱ�����¶ȣ��¶ȶ����������Ӱ�죬����Ҫ����ȴ�����²ſ�ʼ�������ڶ���ʱ��������ӻ����Ӷ�����������Զ���ʱ�۾�������Һ����ʹ���ƽ��
�ʴ�Ϊ���ٴ���ȴ�����²ſ�ʼ�������ڶ���ǰʹ����������Һ����ƽ�����۾�������Һ����ʹ���ƽ��
���������⿼������������װ�ã�Ҫע�����п������ķ�Ӧ������Ũ�Ȳ�ͬʱ��п�����ᷴӦ�������ﲻͬ�����������Ե�Ԫ��Ҳ��ͬ��

��ϰ��ϵ�д�
 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
�����Ŀ
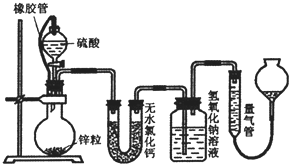 ��ͬŨ�ȵ�������п��Ӧʱ��������Ա���ԭΪS02��Ҳ�ɱ���ԭΪ������ijУ�о���ѧϰС�������ʵ����֤��һ��ʵ�����������ݲⶨ����ؼ��㣮
��ͬŨ�ȵ�������п��Ӧʱ��������Ա���ԭΪS02��Ҳ�ɱ���ԭΪ������ijУ�о���ѧϰС�������ʵ����֤��һ��ʵ�����������ݲⶨ����ؼ��㣮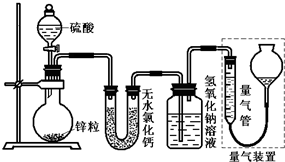 ��ͬŨ�ȵ�������п��Ӧʱ��������Ա���ԭΪSO2��Ҳ�ɱ���ԭΪ������Ϊ����֤��һ��ʵ��ijͬѧ������ͼװ�ý���ʵ�飨ʵ��ʱѹǿΪ10l kPa���¶�Ϊ0�棩��
��ͬŨ�ȵ�������п��Ӧʱ��������Ա���ԭΪSO2��Ҳ�ɱ���ԭΪ������Ϊ����֤��һ��ʵ��ijͬѧ������ͼװ�ý���ʵ�飨ʵ��ʱѹǿΪ10l kPa���¶�Ϊ0�棩��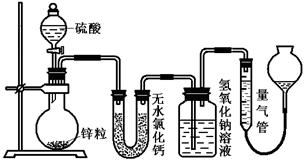
 Ӧ��п��ʣ�࣬�����������ϴ��ƿ����mg��������ʵ����̲����������У�n��H2��/n��SO2����_______________���ú���ĸ�Ĵ���ʽ��ʾ����������ʢ����ˮ�Ȼ��Ƶ�U�ܣ�n��H2��/n��SO2������ֵ��
Ӧ��п��ʣ�࣬�����������ϴ��ƿ����mg��������ʵ����̲����������У�n��H2��/n��SO2����_______________���ú���ĸ�Ĵ���ʽ��ʾ����������ʢ����ˮ�Ȼ��Ƶ�U�ܣ�n��H2��/n��SO2������ֵ��