网址:http://m.1010jiajiao.com/timu3_id_354176[举报]
二十世纪以来,人们发现,引起元素性质周期性变化的本质原因不是相对原子质量的递增,而是核电荷数(原子序数)的递增,也就是核外电子排布的周期性变化。后来,科学家又对元素周期表作了许多改进,如增加了0族等,把元素周期表修正为现在的形式。
根据以上材料,完成下列问题:
(1)门捷列夫提出元素周期律,研究元素性质的周期性变化时,主要是按下列叙述中的哪个顺序排列的?__________。
A.原子序数的递增 B.相对原子质量的递增
C.核外电子排布 D.质子数的递增
(2)元素周期律的真正基础不是元素的相对原子质量,而是原子序数。你是如何解释后者比前者更合理的?__________________________________________
(3)门捷列夫提出的元素周期律的基础虽然不是最科学的,但也解释和预测了许多事实,你认为最可能的原因是什么?__________________________________________
查看习题详情和答案>>(9分)元素周期律是指导我们学习元素及其化合物知识的重要工具。已知氧族元素(不含Po)的部分知识如下表所示,
| 元素 | 8O | 16S | 34Se | 52Te |
| 单质熔点(℃) | -218.4 | 113 | | 450 |
| 单质沸点(℃) | -183 | 444.6 | 685 | 1390 |
| 元素主要化合价 | -2 | -2,+4,+6 | -2,+4,+6 | |
| 原子半径 | 逐渐增大 | |||
| 单质与H2反应情况 | 点燃时易化合 | 加热化合 | 加热难化合 | 不能直接化合 |
(1)单质硒的熔点范围可能是________________。
(2)元素碲的主要化合价可能有________________。
(3)硫、硒、碲的氢化物水溶液的酸性由强至弱的顺序是________________(用化学式表示)。
(4)氢硒酸有较强的__________(填“氧化性”或“还原性”),因此露置在空气中长期保存易变质,其可能发生反应的化学方程式为_________________________________。
(5)下图所示为氧族元素单质与H2反应过程中的能量变化示意图,其中a、b、c、d分别表示氧族元素中某一元素的单质,纵坐标为相同物质的量的单质与H2反应过程中的能量变化(能量变化>0表示放热,能量变化<0表示吸热)。则:b代表___________ _____, d代表 (均写单质名称)。
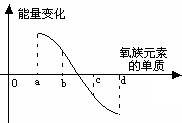 查看习题详情和答案>>
查看习题详情和答案>>
| 元素 | 8O | 16S | 34Se | 52Te |
| 单质熔点(℃) | -218.4 | 113 | | 450 |
| 单质沸点(℃) | -183 | 444.6 | 685 | 1390 |
| 元素主要化合价 | -2 | -2,+4,+6 | -2,+4,+6 | |
| 原子半径 | 逐渐增大 | |||
| 单质与H2反应情况 | 点燃时易化合 | 加热化合 | 加热难化合 | 不能直接化合 |
(1)单质硒的熔点范围可能是________________。
(2)元素碲的主要化合价可能有________________。
(3)硫、硒、碲的氢化物水溶液的酸性由强至弱的顺序是________________(用化学式表示)。
(4)氢硒酸有较强的__________(填“氧化性”或“还原性”),因此露置在空气中长期保存易变质,其可能发生反应的化学方程式为_________________________________。
(5)下图所示为氧族元素单质与H2反应过程中的能量变化示意图,其中a、b、c、d分别表示氧族元素中某一元素的单质,纵坐标为相同物质的量的单质与H2反应过程中的能量变化(能量变化>0表示放热,能量变化<0表示吸热)。则:b代表___________ _____, d代表 (均写单质名称)。
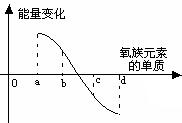
| |||||||||||||||||||||||||

A.原子得到电子所放出的能量
B.原子半径的大小
C.原子逐个失去电子所吸收的能量
D.原子及形成不同分子的半径的大小
(2)分析同周期自左向右各元素原子的第一个数据:
①总体变化趋势是________(填“增大”或“减小”);
②与前后元素相比,由于该元素的数值增大较多而变得反常的元素位于元素周期表的某些族,分析它们的原子核外电子排布,指出造成上述反常情况的可能原因是______(填序号)。
A.它们的原子半径突然变小些
B.它们的核外电子排布处于饱和状态
C.它们的原子半径突然变大些
D.电子填充时,某些原子轨道达到半充满或全满时,体系稳定性提高
根据以上规律,请推测镁和铝的第一个数据的大小关系为:Mg(1)____Al(1)(填“>”或“<”或“=”)。
(3)每种元素的一组数据中个别地方增大的比例特别大,形成突跃(大幅度增大),请找出这些数据,并根据这些数据出现的规律,你认为氧元素出现该情况的数据应该是氧元素8个数据中的第______个。上述规律可以证明原子结构中____________________的结论。