网址:http://m.1010jiajiao.com/timu3_id_353330[举报]
 分析解答下列化学实验和计算问题:
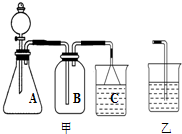
分析解答下列化学实验和计算问题:(1)实验室常有下列仪器:A试管、B烧杯、C量筒、D容量瓶、E烧瓶、F酸式滴定管、
G蒸发皿、H坩埚等(用仪器序号填空)
①上述仪器中可以用来加热,但必须垫上石棉网的是
②“磨砂”是给玻璃仪器加强密闭防漏的一种处理工艺.上述仪器中使用了“磨砂”处理工艺的是
(2)用图甲装置能够完成下列实验中的
A.用锌粒与稀硫酸制取氢气
B.用浓硫酸与浓盐酸制取HCl
C.用浓氨水与生石灰制取NH3
D.用铜与浓硝酸反应制取NO2
(3)如用乙代替甲中的C重新组装成一套 装置,用KMnO4、浓HCl、NaBr溶液、NaOH 溶液来验证KMnO4、Cl2、Br2的氧化性强弱顺序.实验时观察到B中的现象是
(4)某久置的亚硫酸钠样品已部分变成硫酸钠.某同学为测定该样品中亚硫酸钠的质量分数,称取m1g该样品放在烧杯中加入适量蒸馏水完全溶解,加入足量的稀盐酸充分反应,再滴加BaCl2溶液直至沉淀完全.经过滤、洗涤、干燥、称量得m2g沉淀.
①判断SO42-沉淀完全的实验方法是
②该样品中亚硫酸钠的质量分数是
| 233m1-142m2 |
| 233m1 |
| 233m1-142m2 |
| 233m1 |
 运用化学反应原理研究元素及其化合物的反应对生产、生活有重要意义.
运用化学反应原理研究元素及其化合物的反应对生产、生活有重要意义.请回答下列问题:
(1)工业上以辉铜矿(主要成分 Cu2S)为原料,采取火法熔炼工艺生产铜.该过程中有如下反应:
2Cu2S(s)+3O2(g)=2Cu2O(s)十2SO2(g)△H=-768.2KJ?mol-1
2Cu2O(s)+Cu2S(s)=6Cu(s)+SO2(g)△H=+116.0KJ?mol-1
则反应Cu2S(s)+O2(g)=2Cu(s)+SO2(g)的△H=
(2)硫酸生产中涉及反应:2SO2(g)+O2(g)?2SO3(g).
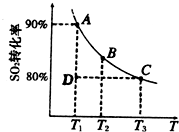
①一定条件下,的平衡转化率和温度的关系如右图所示.该反应的△H
②某温度时,将4molSO2和2molO2通入2L密闭容器中,10min时反应达到平衡状态,测得SO3的浓度为1.6mol?L-1,则0~10min内的平均反应速率v(SO2)=
③下列叙述能证明该反应已经达到化学平衡状态的是(填标号,下同)
A.容器内压强不再发生变化 B.SO2的体积分数不再发生变化?
C.容器内气体质量不再发生变化 D.容器内气体密度不再发生变化?
④以下操作将引起平衡向正反应方向移动并能提高SO2转化率的是
A.向容器中通入少量O2 B.向容器中通入少量SO2?C.使用催化剂 D.升高温度?E.恒容通入少量氦气?
⑤气体SO2是大气污染物,可选用下列试剂中的
a.浓H2SO4 b.稀HNO3 c.NaOH溶液 d.氨.
请回答下列问题:
(1)工业上以辉铜矿(主要成分 Cu2S)为原料,采取火法熔炼工艺生产铜.该过程中有如下反应:
2Cu2S(s)+3O2(g)=2Cu2O(s)十2SO2(g)△H=-768.2KJ?mol-1
2Cu2O(s)+Cu2S(s)=6Cu(s)+SO2(g)△H=+116.0KJ?mol-1
则反应Cu2S(s)+O2(g)=2Cu(s)+SO2(g)的△H=______.
(2)硫酸生产中涉及反应:2SO2(g)+O2(g)?2SO3(g).
①一定条件下,的平衡转化率和温度的关系如右图所示.该反应的△H______O(填“>”或“<”).反应进行到状态D时,v正______v逆(填“>”、“<”或“=”).?
②某温度时,将4molSO2和2molO2通入2L密闭容器中,10min时反应达到平衡状态,测得SO3的浓度为1.6mol?L-1,则0~10min内的平均反应速率v(SO2)=______,该温度下反应的平衡常数K=______.
③下列叙述能证明该反应已经达到化学平衡状态的是(填标号,下同)______
A.容器内压强不再发生变化 B.SO2的体积分数不再发生变化?
C.容器内气体质量不再发生变化 D.容器内气体密度不再发生变化?
④以下操作将引起平衡向正反应方向移动并能提高SO2转化率的是______?
A.向容器中通入少量O2 B.向容器中通入少量SO2?C.使用催化剂 D.升高温度?E.恒容通入少量氦气?
⑤气体SO2是大气污染物,可选用下列试剂中的______吸收.
a.浓H2SO4 b.稀HNO3 c.NaOH溶液 d.氨.
运用化学反应原理研究元素及其化合物的反应对生产、生活有重要意义。
请回答下列问题:
(1)工业上以辉铜矿(主要成分 Cu2S)为原料,采取火法熔炼工艺生产铜。该过程中有如下反应:
2Cu2S(s)+3O2(g)=2Cu2O(s)十2SO2(g) △H=-768.2KJ·mol-1
2Cu2O(s)+Cu2S(s)=6Cu(s)+SO2(g) △H=+116.0KJ·mol-1
则反应Cu2S(s)+O2(g)=2Cu(s)+SO2(g)的 △H= 。
 (2)硫酸生产中涉及反应:2SO
(2)硫酸生产中涉及反应:2SO![]() (g)+O
(g)+O![]() (g)
(g)![]() 2SO
2SO![]() (g)。 ① 一定条件下,的平衡转化率和温度的关系如右图所示。该反应的ΔH O(填“>”或“<”)。反应进行到状态D时,v正 v逆(填“>”、“<”或“=”)。
(g)。 ① 一定条件下,的平衡转化率和温度的关系如右图所示。该反应的ΔH O(填“>”或“<”)。反应进行到状态D时,v正 v逆(填“>”、“<”或“=”)。
② 某温度时,将4molSO2和2molO2通入2L密闭容器中,10min时反应达到平衡状态,测得SO3的浓度为1.6mol·L-1,则0~10min内的平均反应速率v(SO2)= ,该温度下反应的平衡常数K= 。
③ 下列叙述能证明该反应已经达到化学平衡状态的是(填标号,下同)
A.容器内压强不再发生变化 B.SO![]() 的体积分数不再发生变化
的体积分数不再发生变化
C.容器内气体质量不再发生变化 D.容器内气体密度不再发生变化
④ 以下操作将引起平衡向正反应方向移动并能提高SO![]() 转化率的是
转化率的是
A.向容器中通入少量O![]() B.向容器中通入少量SO
B.向容器中通入少量SO![]()
C.使用催化剂 D.升高温度 E.恒容通入少量氦气
⑤ 气体SO2是大气污染物,可选用下列试剂中的_______吸收。
a.浓H2SO4 b.稀HNO3 c.NaOH溶液 d.氨
查看习题详情和答案>>请回答下列问题:
(1)工业上以辉铜矿(主要成分 Cu2S)为原料,采取火法熔炼工艺生产铜.该过程中有如下反应:
2Cu2S(s)+3O2(g)=2Cu2O(s)十2SO2(g)△H=-768.2KJ?mol-1
2Cu2O(s)+Cu2S(s)=6Cu(s)+SO2(g)△H=+116.0KJ?mol-1
则反应Cu2S(s)+O2(g)=2Cu(s)+SO2(g)的△H= .
(2)硫酸生产中涉及反应:2SO2(g)+O2(g)?2SO3(g).
①一定条件下,的平衡转化率和温度的关系如右图所示.该反应的△H O(填“>”或“<”).反应进行到状态D时,v正 v逆(填“>”、“<”或“=”).?
②某温度时,将4molSO2和2molO2通入2L密闭容器中,10min时反应达到平衡状态,测得SO3的浓度为1.6mol?L-1,则0~10min内的平均反应速率v(SO2)= ,该温度下反应的平衡常数K= .
③下列叙述能证明该反应已经达到化学平衡状态的是(填标号,下同)
A.容器内压强不再发生变化 B.SO2的体积分数不再发生变化?
C.容器内气体质量不再发生变化 D.容器内气体密度不再发生变化?
④以下操作将引起平衡向正反应方向移动并能提高SO2转化率的是 ?
A.向容器中通入少量O2 B.向容器中通入少量SO2?C.使用催化剂 D.升高温度?E.恒容通入少量氦气?
⑤气体SO2是大气污染物,可选用下列试剂中的 吸收.
a.浓H2SO4 b.稀HNO3 c.NaOH溶液 d.氨.
 查看习题详情和答案>>
查看习题详情和答案>>