题目内容
 分析解答下列化学实验和计算问题:
分析解答下列化学实验和计算问题:(1)实验室常有下列仪器:A试管、B烧杯、C量筒、D容量瓶、E烧瓶、F酸式滴定管、
G蒸发皿、H坩埚等(用仪器序号填空)
①上述仪器中可以用来加热,但必须垫上石棉网的是
B、E
B、E
.②“磨砂”是给玻璃仪器加强密闭防漏的一种处理工艺.上述仪器中使用了“磨砂”处理工艺的是
D、F
D、F
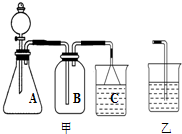
.(2)用图甲装置能够完成下列实验中的
B、D
B、D
.(填序号)A.用锌粒与稀硫酸制取氢气
B.用浓硫酸与浓盐酸制取HCl
C.用浓氨水与生石灰制取NH3
D.用铜与浓硝酸反应制取NO2
(3)如用乙代替甲中的C重新组装成一套 装置,用KMnO4、浓HCl、NaBr溶液、NaOH 溶液来验证KMnO4、Cl2、Br2的氧化性强弱顺序.实验时观察到B中的现象是
溶液由无色变为橙黄色
溶液由无色变为橙黄色
.(4)某久置的亚硫酸钠样品已部分变成硫酸钠.某同学为测定该样品中亚硫酸钠的质量分数,称取m1g该样品放在烧杯中加入适量蒸馏水完全溶解,加入足量的稀盐酸充分反应,再滴加BaCl2溶液直至沉淀完全.经过滤、洗涤、干燥、称量得m2g沉淀.
①判断SO42-沉淀完全的实验方法是
静置一段时间后,取少量上层清液再滴加BaCl2溶液,若无沉淀生成,说明SO42-沉淀完全,反之未沉淀完全;
静置一段时间后,取少量上层清液再滴加BaCl2溶液,若无沉淀生成,说明SO42-沉淀完全,反之未沉淀完全;
.②该样品中亚硫酸钠的质量分数是
| 233m1-142m2 |
| 233m1 |
| 233m1-142m2 |
| 233m1 |
偏小
偏小
(填“偏大”、“偏小”或“无影响”).分析:(1)①可垫石棉网加热的仪器有:烧杯、烧瓶;②磨砂的作用就是增强摩擦,密封盖口,让气体和液体跑不出去;
(2)A.用锌粒与稀硫酸制取氢气,氢气通过多用瓶收集时应短进长出;
B.用浓硫酸与浓盐酸制取HCl,HCl通过多用瓶收集时应长进短出,HCl易溶于水,注意防倒吸;
C.用浓氨水与生石灰制取NH3,NH3通过多用瓶收集时应短进长出,NH3易溶于水,注意防倒吸;
D.用铜与浓硝酸反应制取NO2,NO2通过多用瓶收集时应长进短出,NO2能与水反应,注意防倒吸;
(3)根据KMnO4与浓HCl反应产生Cl2,说明氧化性:KMnO4>Cl2,Cl2与NaBr溶液反应生成Br2,说明氧化性:Cl2>Br2,多余的Cl2用NaOH 溶液来吸收;
(4)①硫酸根遇到钡离子会产生白色沉淀;
②称取该样品放在烧杯中加入适量蒸馏水完全溶解,加入足量的稀盐酸充分反应,再滴加BaCl2溶液直至沉淀完全,发生的反应有:2HCl+Na2SO3=2NaCl+SO2↑+H2O,Na2SO4+BaCl2=BaSO4↓+2NaCl,根据Na2SO4+BaCl2=BaSO4↓+2NaCl来计算出Na2SO4的质量,然后求出亚硫酸钠的质量分数;根据过滤后省去沉淀的洗涤操作,导致m2偏大来分析;
(2)A.用锌粒与稀硫酸制取氢气,氢气通过多用瓶收集时应短进长出;
B.用浓硫酸与浓盐酸制取HCl,HCl通过多用瓶收集时应长进短出,HCl易溶于水,注意防倒吸;
C.用浓氨水与生石灰制取NH3,NH3通过多用瓶收集时应短进长出,NH3易溶于水,注意防倒吸;
D.用铜与浓硝酸反应制取NO2,NO2通过多用瓶收集时应长进短出,NO2能与水反应,注意防倒吸;
(3)根据KMnO4与浓HCl反应产生Cl2,说明氧化性:KMnO4>Cl2,Cl2与NaBr溶液反应生成Br2,说明氧化性:Cl2>Br2,多余的Cl2用NaOH 溶液来吸收;
(4)①硫酸根遇到钡离子会产生白色沉淀;
②称取该样品放在烧杯中加入适量蒸馏水完全溶解,加入足量的稀盐酸充分反应,再滴加BaCl2溶液直至沉淀完全,发生的反应有:2HCl+Na2SO3=2NaCl+SO2↑+H2O,Na2SO4+BaCl2=BaSO4↓+2NaCl,根据Na2SO4+BaCl2=BaSO4↓+2NaCl来计算出Na2SO4的质量,然后求出亚硫酸钠的质量分数;根据过滤后省去沉淀的洗涤操作,导致m2偏大来分析;
解答:解:(1)①为防止因局部受热,使仪器炸裂,要垫石棉网加热的仪器是烧杯和烧瓶,试管、蒸发皿、坩埚直接加热,量筒、容量瓶、酸式滴定管不能加热,故答案为:B、E
②磨砂的作用就是增强摩擦,密封盖口,让气体和液体跑不出去;容量瓶、酸式滴定管磨砂不让液体流出,故答案为:D、F;
(2)A.用锌粒与稀硫酸制取氢气,氢气通过多用瓶收集时应短进长出,故A错误;
B.用浓硫酸与浓盐酸制取HCl,HCl通过多用瓶收集时应长进短出,HCl易溶于水,注意防倒吸,故B正确;
C.用浓氨水与生石灰制取NH3,NH3通过多用瓶收集时应短进长出,NH3易溶于水,注意防倒吸,故C错误;
D.用铜与浓硝酸反应制取NO2,NO2通过多用瓶收集时应长进短出,NO2能与水反应,注意防倒吸,故D正确;
故选:B、D;
(3)A中KMnO4与浓HCl反应产生Cl2,B中Cl2与NaBr溶液反应生成Br2,溶液由无色变为橙黄色,C中多余的Cl2用NaOH 溶液来吸收;故答案为:溶液由无色变为橙黄色;
(4)①如果所加的氯化钡是少量的,则溶液中含有硫酸根离子,钡离子遇到硫酸根离子会生成白色沉淀,故答案为:静置一段时间后,取少量上层清液再滴加BaCl2溶液,若无沉淀生成,说明SO42-沉淀完全,反之未沉淀完全;
②称取该样品放在烧杯中加入适量蒸馏水完全溶解,加入足量的稀盐酸充分反应,再滴加BaCl2溶液直至沉淀完全,发生的反应有:2HCl+Na2SO3=2NaCl+SO2↑+H2O,Na2SO4+BaCl2=BaSO4↓+2NaCl,
Na2SO4+BaCl2=BaSO4↓+2NaCl
142 233
m(Na2SO4) m2g
m(Na2SO4)=
g,则 Na2SO3的质量为:m1g-
g=
g,
所以亚硫酸钠的质量分数是
×100%,
过滤后省去沉淀的洗涤操作,导致m2偏大,
值偏小,
×100%偏小,
故答案为:
×100%;偏小;
②磨砂的作用就是增强摩擦,密封盖口,让气体和液体跑不出去;容量瓶、酸式滴定管磨砂不让液体流出,故答案为:D、F;
(2)A.用锌粒与稀硫酸制取氢气,氢气通过多用瓶收集时应短进长出,故A错误;
B.用浓硫酸与浓盐酸制取HCl,HCl通过多用瓶收集时应长进短出,HCl易溶于水,注意防倒吸,故B正确;
C.用浓氨水与生石灰制取NH3,NH3通过多用瓶收集时应短进长出,NH3易溶于水,注意防倒吸,故C错误;
D.用铜与浓硝酸反应制取NO2,NO2通过多用瓶收集时应长进短出,NO2能与水反应,注意防倒吸,故D正确;
故选:B、D;
(3)A中KMnO4与浓HCl反应产生Cl2,B中Cl2与NaBr溶液反应生成Br2,溶液由无色变为橙黄色,C中多余的Cl2用NaOH 溶液来吸收;故答案为:溶液由无色变为橙黄色;
(4)①如果所加的氯化钡是少量的,则溶液中含有硫酸根离子,钡离子遇到硫酸根离子会生成白色沉淀,故答案为:静置一段时间后,取少量上层清液再滴加BaCl2溶液,若无沉淀生成,说明SO42-沉淀完全,反之未沉淀完全;
②称取该样品放在烧杯中加入适量蒸馏水完全溶解,加入足量的稀盐酸充分反应,再滴加BaCl2溶液直至沉淀完全,发生的反应有:2HCl+Na2SO3=2NaCl+SO2↑+H2O,Na2SO4+BaCl2=BaSO4↓+2NaCl,
Na2SO4+BaCl2=BaSO4↓+2NaCl
142 233
m(Na2SO4) m2g
m(Na2SO4)=
| 142m2 |
| 233 |
| 142m2 |
| 233 |
| 233m1-142m2 |
| 233 |
所以亚硫酸钠的质量分数是
| 233m1-142m2 |
| 233m1 |
过滤后省去沉淀的洗涤操作,导致m2偏大,
| 233m1-142m2 |
| 233 |
| 233m1-142m2 |
| 233m1 |
故答案为:
| 233m1-142m2 |
| 233m1 |
点评:本题考查实验方案的理解与对操作的评价、离子的检验等,难度不大,是对所需知识的综合考查,需要学生具有扎实的基础与综合运用分析能力.

练习册系列答案
相关题目
 请你与小王同学一道完成下列问题的分析解答:
请你与小王同学一道完成下列问题的分析解答: 分析解答下列化学实验和计算问题:
分析解答下列化学实验和计算问题: