网址:http://m.1010jiajiao.com/timu3_id_353267[举报]
(1)水是极弱的电解质,也是最重要的溶剂.常温下某电解质溶解在水中后,溶液中的c(H+)=10-9mol?L-1,则该电解质可能是______(填序号).
A. CuSO4 B. HCl C. Na2S D.NaOH E.K2SO4
(2)已知次氯酸是比碳酸还弱的酸,要使新制稀氯水中的c(HC10)增大,可以采取的措施为(至少回答两种)______.
(3)常温下,将pH=3的盐酸a L分别与下列三种溶液混合,结果溶液均呈中性.
①浓度为1.0×10-3mol.L-1的氨水b L;②c(OH -)=1.0×10-3mol.L-l的氨水c L;③c(OH-)=1.0×10-3mol?L-1的氢氧化钡溶液d L.则a、b、c、d之间的关系是:______.
(4)强酸制弱酸是水溶液中的重要经验规律.
①已知HA、H2B是两种弱酸,存在以下关系:H2B(少量)+2A-=B2-+2HA,则A-、B2-、HB-三种阴离子结合H+的难易顺序为______.
②某同学将H2S通入CuSO4溶液中发现生成黑色沉淀,查阅资料并在老师的指导下写出了化学方程式:H2S+CuSO4=CuS↓+H2SO4,但这位同学陷入了困惑:这不成了弱酸制取强酸了吗?请你帮助解释______.
(5)已知:H2A═H++HA-、HA-?H++A2-,常温下,0.1mol.L-1的NaH A溶液其pH=2,则0.1mol?L-1的H2A溶液中氢离子浓度的大小范围是:______;NaHA溶液中各种离子浓度大小关系为______.
(6)己知:Ksp(AgCl)=1.8×10-10mol?L-1,向50mL 0.018mo1?L-l的AgNO3溶液中加入相同体积0.020mol?L-1的盐酸,则c(Ag+)=______,此时所得混合溶液的pH=______.
查看习题详情和答案>>
(15分)下图是中学化学常见物质的转化关系(某些反应条件及部分产物已略去),A、G为日常生活中的常见金属。B、C、E、I、J为气体,其中C为黄绿色气体,M为红褐色胶体。
(1)已知A为第26号元素,请写出A元素在周期表中的位置__________。
(2)D与G反应的化学方程式_________________________。
(3)反应②离子方程式__________________________。
(4)F→M的操作方法_______________。
(5)现将一试管J气体倒立于水槽中一段时间后,水面上升但不充满;若使水充满整个试管,应向试管中通入一定量__________(填气体的化学式),此时试管中溶液的浓度为________mol/L(气体体积按标准状况计算)(保留两位有效数字)。
(6)①X、Y均为短周期元素,X最外层电子数比C气体所含元素最外层电子少1个且不同周期,Y与X同主族,下列关于X、Y、C三元素说法正确的是__________。
A.原子半径 X<Y<C B.离子半径 X<C<Y
C.非金属性 X<Y<C D.最高价氧化物对应水化物酸性 C>X>Y
E.氢化物沸点 X<Y<C
② 请写出X的氢化物中原子个数比为1:1的化合物的电子式_________。
(7)D与G反应生成A的同时,还有另一种产物,工业上用铝土矿(主要成分为Al2O3、、SiO2、Fe2O3)提取其的工艺流程如下:
结合反应II,判断下列微粒结合质子(H+)的能力由强到弱的顺序是_________(填字母序号)。
A.AlO2— B.OH— C.SiO32—
查看习题详情和答案>>
(15分)下图是中学化学常见物质的转化关系(某些反应条件及部分产物已略去),A、G为日常生活中的常见金属。B、C、E、I、J为气体,其中C为黄绿色气体,M为红褐色胶体。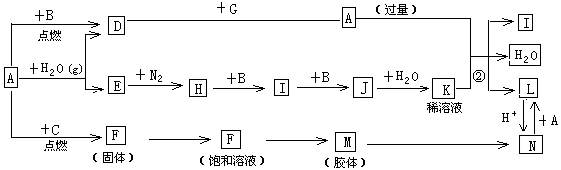
(1)已知A为第26号元素,请写出A元素在周期表中的位置__________。
(2)D与G反应的化学方程式_________________________。
(3)反应②离子方程式__________________________。
(4)F→M的操作方法_______________。
(5)现将一试管J气体倒立于水槽中一段时间后,水面上升但不充满;若使水充满整个试管,应向试管中通入一定量__________(填气体的化学式),此时试管中溶液的浓度为________mol/L(气体体积按标准状况计算)(保留两位有效数字)。
(6)①X、Y均为短周期元素,X最外层电子数比C气体所含元素最外层电子少1个且不同周期,Y与X同主族,下列关于X、Y、C三元素说法正确的是__________。
A.原子半径 X<Y<C B.离子半径 X<C<Y
C.非金属性 X<Y<C D.最高价氧化物对应水化物酸性 C>X>Y
E.氢化物沸点 X<Y<C
②请写出X的氢化物中原子个数比为1:1的化合物的电子式_________。
(7)D与G反应生成A的同时,还有另一种产物,工业上用铝土矿(主要成分为Al2O3、、SiO2、Fe2O3)提取其的工艺流程如下:
结合反应II,判断下列微粒结合质子(H+)的能力由强到弱的顺序是_________(填字母序号)。
A.AlO2— B.OH— C.SiO32—
下图是中学化学常见物质的转化关系(某些反应条件及部分产物已略去),A、G为日常生活中的常见金属。B、C、E、I、J为气体,其中C为黄绿色气体,M为红褐色胶体。
 |
(1)已知A为第26号元素,请写出A元素在周期表中的位置__________
(2)D与G反应的化学方程式_________________________
(3)反应②离子方程式__________________________
(4)F→M的操作方法_______________
(5)现将一试管J气体倒立于水槽中一段时间后,水面上升但不充满;若使水充满整个试管,应向试管中通入一定量__________(填气体的化学式),此时试管中溶液的浓度为________mol/L(气体体积按标准状况计算)(保留两位有效数字)。
(6)①X、Y均为短周期元素,X最外层电子数比C气体所含元素最外层电子少1个且不同周期,Y与X同主族,下列关于X、Y、C三元素说法正确的是__________
A 原子半径 X〈 Y〈 C B 离子半径 X〈 C〈 Y
C 非金属性 X〈 Y〈 C D 最高价氧化物对应水化物酸性 C 〉X 〉Y
E 氢化物沸点 X〈 Y〈 C
② 请写出X的氢化物中原子个数比为1:1的化合物的电子式_________
(7)D与G反应生成A的同时,还有另一种产物,工业上用铝土矿(主要成分为Al2O3、、SiO2、Fe2O3)提取其的工艺流程如下:
 |
结合反应II,判断下列微粒结合质子(H+)的能力由强到弱的顺序是_________(填字母序号)
A. AlO2— B. OH— C. SiO32—
查看习题详情和答案>>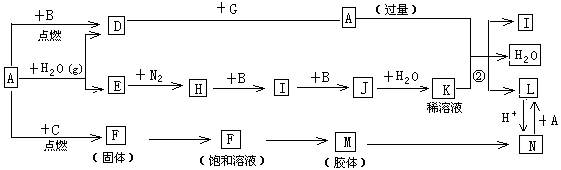
(1)已知A为第26号元素,请写出A元素在周期表中的位置__________。
(2)D与G反应的化学方程式_________________________。
(3)反应②离子方程式__________________________。
(4)F→M的操作方法_______________。
(5)现将一试管J气体倒立于水槽中一段时间后,水面上升但不充满;若使水充满整个试管,应向试管中通入一定量__________(填气体的化学式),此时试管中溶液的浓度为________mol/L(气体体积按标准状况计算)(保留两位有效数字)。
(6)①X、Y均为短周期元素,X最外层电子数比C气体所含元素最外层电子少1个且不同周期,Y与X同主族,下列关于X、Y、C三元素说法正确的是__________。
A.原子半径 X<Y<C B.离子半径 X<C<Y
C.非金属性 X<Y<C D.最高价氧化物对应水化物酸性 C>X>Y
E.氢化物沸点 X<Y<C
②请写出X的氢化物中原子个数比为1:1的化合物的电子式_________。
(7)D与G反应生成A的同时,还有另一种产物,工业上用铝土矿(主要成分为Al2O3、、SiO2、Fe2O3)提取其的工艺流程如下:
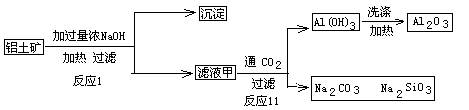
结合反应II,判断下列微粒结合质子(H+)的能力由强到弱的顺序是_________(填字母序号)。
A.AlO2— B.OH— C.SiO32—