摘要:12.在密闭容器中,反应2SO2 + O2?2SO3 + Q在一定条件下达平衡状态,此时SO2.O2.SO3物质的量之比为3∶2∶5,其他条件不变,升温后达新的平衡状态,此时容器中含SO2 1.4 mol.O2 0.9 mol,则新平衡时含SO3的物质的量为( ) A.1.8 mol B.2 mol C.2.2 mol D.2.4 mol
网址:http://m.1010jiajiao.com/timu3_id_353159[举报]
联氨(N2H4)及其衍生物是一类重要的火箭燃料,N2H4与N2O4反应能放出大量的热.(1)已知:2NO2(g)?N2O4(g)△H=-57.20KJ?mol-1.一定温度下,在密闭容器中反应2NO2(g)?N2O4(g)达到平衡.其他条件不变时,下列措施能提高NO2转化率的是 (填字母)
A.减小NO2的浓度 B.降低温度 C.增加NO2的浓度 D.升高温度
(2)25℃时,1.00gN2H4(l)与足量N2O4(l)完全反应生成N2(g)和H2O(l),放出19.14kJ的热量.写出该反应的热化学方程式 .
查看习题详情和答案>>
A.减小NO2的浓度 B.降低温度 C.增加NO2的浓度 D.升高温度
(2)25℃时,1.00gN2H4(l)与足量N2O4(l)完全反应生成N2(g)和H2O(l),放出19.14kJ的热量.写出该反应的热化学方程式
 联氨(N2H4)及其衍生物是重要的火箭燃料,N2H4与N2O4反应能放出大量的热.
联氨(N2H4)及其衍生物是重要的火箭燃料,N2H4与N2O4反应能放出大量的热.(1)25℃时,1.00g N2H4(l)与足量N2O4(l)完全反应生成N2(g)和H2O(l),放出19.14kJ的热量.则反应2N2H4(l)+N2O4(l)=3N2(g)+4H2O(l)的△H=
-1224.96
-1224.96
kJ?mol-1.(2)已知:2NO2(g)?N2O4(g)△H=-57.20kJ?mol-1.一定温度下,在密闭容器中反应2NO2(g)?N2O4(g)达到平衡.其它条件不变时,下列措施能提高NO2转化率的是
BC
BC
.A.减小NO2的浓度 B.降低温度
C.增加NO2的浓度 D.升高温度
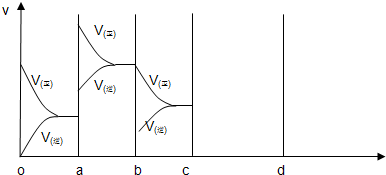
(3)图中共有两条曲线X和Y,其中曲线
Y
Y
表示N2O4浓度随时间的变化;a、b、c、d四个点中,表示化学反应处于平衡状态的是b、d
b、d
,并计算此条件下反应2NO2(g)?N2O4(g)的平衡常数为1.11
1.11
.(1)某温度下,10L密闭容器中加入5molSO2、4.5molO2,经10min后反应达平衡时有3molSO2发生了反应.
①用SO2表示该反应的反应速率为
②O2的转化率为
③平衡时体系中SO3的体积分数为
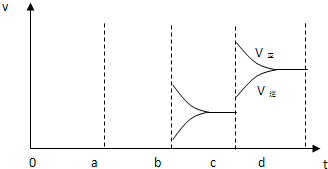
(2)下图表示在密闭容器中反应:CO2(g)+C (s)?2CO(g)△H>0,达到平衡后,由于改变某一条件而引起反应速度(v)和化学平衡的变化情况,
①a b过程中改变的条件可能是
②bc段,平衡
③若缩小容器体积使体系压强增大时,平衡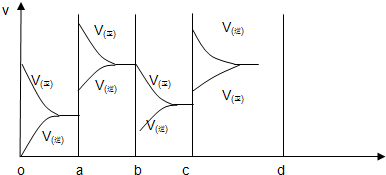
 .
.
查看习题详情和答案>>
①用SO2表示该反应的反应速率为
0.03mol.L-1min-1
0.03mol.L-1min-1
,用O2表示的速率为:0.015mol.L-1min-1
0.015mol.L-1min-1
②O2的转化率为
33.3%
33.3%
③平衡时体系中SO3的体积分数为
37.5%
37.5%
(2)下图表示在密闭容器中反应:CO2(g)+C (s)?2CO(g)△H>0,达到平衡后,由于改变某一条件而引起反应速度(v)和化学平衡的变化情况,
①a b过程中改变的条件可能是
降温
降温
;(选填:升温、降温、加压(缩小容器体积))②bc段,平衡
正反应方向移动
正反应方向移动
(选填“正反应方向移动”“逆反应方向移动”“不移动”),③若缩小容器体积使体系压强增大时,平衡
逆反应方向移动
逆反应方向移动
(选填“正反应方向移动”“逆反应方向移动”“不移动”),反应速度变化情况在c-d段作出


 (1)对于下列反应:2SO2+O2?2SO3,如果2min内SO2的浓度由6mol/L下降为2mol/L,那么,用SO2浓度变化来表示的化学反应速率为
(1)对于下列反应:2SO2+O2?2SO3,如果2min内SO2的浓度由6mol/L下降为2mol/L,那么,用SO2浓度变化来表示的化学反应速率为2mol/(L?min)
2mol/(L?min)
,如果开始时SO2浓度为4mol/L,2min后反应达平衡,若这段时间内v(O2)为0.5mol/(L?min),那么2min时SO2的浓度为2mol/L
2mol/L
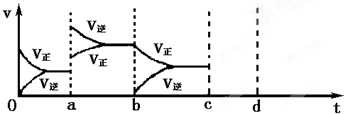
.(2)如图表示在密闭容器中反应:2SO2+O2?2SO3放热反应,达到平衡时,由于条件改变而引起反应速度的变化情况,a b过程中改变的条件可能是;b c过程中改变的条件可能是; 若增大压强时,反应速度变化情况画在c~d处.