摘要:3.某主族元素的最高价含氧酸的阴离子的符号是RO3-.则该元素的气态氢化物的化学式是 ( ) A.HR B.H2R C.RH3 D.RH4
网址:http://m.1010jiajiao.com/timu3_id_352762[举报]
短周期元素A、X、D、E、R、T原子序数依次增大,原子结构及性质如表所示:
元素 | 结构及性质 |
A | A的原子半径最小 |
X | X原子最外层电子数是次外层的两倍 |
D | D是短周期中金属性最强的元素 |
E | E的最高价氧化物对应水化物是一种常见的两性氢氧化物 |
R | R与X同主族 |
T | T的负一价阴离子的核外电子排布与Ar原子相同 |
(1)R元素在周期表的位置是???????????? ,化合物DT中存在的化学键是????????? 。
(2)写出E单质与NaOH溶液反应的离子方程式 ???????????????????????????????? 。
(3)1g X2A4 完全燃烧,恢复到常温时放出a kJ的热量,写出X2A4完全燃烧的热化学方程式??????????????????????????????????????????????????????????????????? 。
(4)RT4极易水解生成两种酸,写出该反应的化学方程式?????????????????????????? 。
(5)已知某温度下T的某一元含氧酸的Ka = 4.0×10-8,若一定浓度该酸的pH=4,则此溶液的物质的量浓度为?????????????? 。
查看习题详情和答案>>
短周期元素A、X、D、E、R、T原子序数依次增大,原子结构及性质如表所示:
| 元素 | 结构及性质 |
| A | A的原子半径最小 |
| X | X原子最外层电子数是次外层的两倍 |
| D | D是短周期中金属性最强的元素 |
| E | E的最高价氧化物对应水化物是一种常见的两性氢氧化物 |
| R | R与X同主族 |
| T | T的负一价阴离子的核外电子排布与Ar原子相同 |
(1)R元素在周期表的位置是 ,化合物DT中存在的化学键是 。
(2)写出E单质与NaOH溶液反应的离子方程式 。
(3)1g X2A4 完全燃烧,恢复到常温时放出a kJ的热量,写出X2A4完全燃烧的热化学方程式 。
(4)RT4极易水解生成两种酸,写出该反应的化学方程式 。
(5)已知某温度下T的某一元含氧酸的Ka = 4.0×10-8,若一定浓度该酸的pH=4,则此溶液的物质的量浓度为 。 查看习题详情和答案>>
短周期元素A、X、D、E、R、T原子序数依次增大,原子结构及性质如表所示:
(1)R元素在周期表的位置是 ,化合物DT中存在的化学键是 。
(2)写出E单质与NaOH溶液反应的离子方程式 。
(3)1g X2A4 完全燃烧,恢复到常温时放出a kJ的热量,写出X2A4完全燃烧的热化学方程式 。
(4)RT4极易水解生成两种酸,写出该反应的化学方程式 。
(5)已知某温度下T的某一元含氧酸的Ka = 4.0×10-8,若一定浓度该酸的pH=4,则此溶液的物质的量浓度为 。
| 元素 | 结构及性质 |
| A | A的原子半径最小 |
| X | X原子最外层电子数是次外层的两倍 |
| D | D是短周期中金属性最强的元素 |
| E | E的最高价氧化物对应水化物是一种常见的两性氢氧化物 |
| R | R与X同主族 |
| T | T的负一价阴离子的核外电子排布与Ar原子相同 |
(1)R元素在周期表的位置是 ,化合物DT中存在的化学键是 。
(2)写出E单质与NaOH溶液反应的离子方程式 。
(3)1g X2A4 完全燃烧,恢复到常温时放出a kJ的热量,写出X2A4完全燃烧的热化学方程式 。
(4)RT4极易水解生成两种酸,写出该反应的化学方程式 。
(5)已知某温度下T的某一元含氧酸的Ka = 4.0×10-8,若一定浓度该酸的pH=4,则此溶液的物质的量浓度为 。
(2009?商丘二模)短周期元素A、B、C、D原子序数依次增大,且只有C为金属元素.A、C位于同一主族,B的最外层电子数是次外层的3倍,B、C的最外层电子数之和与D的最外层电子数相等.
(1)D的最高价氧化物对应水化物的名称为
(2)C2B2中含有的化学键类型为
(3)由上述四种元素中的三种组成的某种盐,水溶液显碱性,是家用消毒剂的主要成分.将该盐溶液滴入Kl淀粉溶液中,溶液变为蓝色,则反应的离子方程式为
(4)用石墨电极电解化合物CD的饱和溶液,阴极的电极反应式为:
(5)1g A的气态单质与B的气态单质反应生成气态A2B时放出Q kJ热量,该反应的热化学方程式为
查看习题详情和答案>>
(1)D的最高价氧化物对应水化物的名称为
高氯酸
高氯酸
;(2)C2B2中含有的化学键类型为
离子键和非极性键
离子键和非极性键
;(3)由上述四种元素中的三种组成的某种盐,水溶液显碱性,是家用消毒剂的主要成分.将该盐溶液滴入Kl淀粉溶液中,溶液变为蓝色,则反应的离子方程式为
2I-+ClO-+H2O=I2+Cl-+2OH-
2I-+ClO-+H2O=I2+Cl-+2OH-
;(4)用石墨电极电解化合物CD的饱和溶液,阴极的电极反应式为:
2H++2e-=H2↑
2H++2e-=H2↑
;若反应后溶液的体积为200mL,测得pH为13,则阳极得到的气体质量为0.71g
0.71g
;(5)1g A的气态单质与B的气态单质反应生成气态A2B时放出Q kJ热量,该反应的热化学方程式为
2H2(g)+O2(g)=2H2O(g)△H=-4QkJ/mol
2H2(g)+O2(g)=2H2O(g)△H=-4QkJ/mol
.
下表中列出五种短周期元素A、B、C、D、E的信息,请推断后作答:
(1)画出B的离子结构示意图 ;写出D元素最高价氧化物的水化物电子式 .
(2)盐X水溶液显 (填“酸”“碱”“中”)性,用离子方程式解释其原因 .
(3)D2CA3的溶液与B的单质能发生反应,其反应的离子方程式为 .
(4)已知E元素的某种氢化物Y与A2的摩尔质量相同.Y与空气组成的燃料电池是一种碱性燃料电池,电解质溶液是20~30%的KOH溶液.该燃料电池放电时,正极的电极反应式是 .
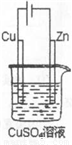
(5)如图是一个电解过程示意图.假设使用Y-空气燃料电池作为本过程的电源,铜片质量变化128g,则Y一空气燃料电池理论上消耗标准状况下的空气(设空气中氧气的体积含量为20%) L.
 查看习题详情和答案>>
查看习题详情和答案>>
| 元素 | 有关信息 |
| A | 元素主要化合价为-2,原子半径为0.074n m |
| B | 所在主族序数与所在周期序数之差为4 |
| C | 原子半径为0.102n m,其单质在A的单质中燃烧,发出明亮的蓝紫色火焰 |
| D | 最高价氧化物的水化物,能按1:1电离出电子数相等的阴、阳离子 |
| E | 原子半径为0.075n m,最高价氧化物的水化物与其氢化物组成一种盐X |
(2)盐X水溶液显 (填“酸”“碱”“中”)性,用离子方程式解释其原因 .
(3)D2CA3的溶液与B的单质能发生反应,其反应的离子方程式为 .
(4)已知E元素的某种氢化物Y与A2的摩尔质量相同.Y与空气组成的燃料电池是一种碱性燃料电池,电解质溶液是20~30%的KOH溶液.该燃料电池放电时,正极的电极反应式是 .
(5)如图是一个电解过程示意图.假设使用Y-空气燃料电池作为本过程的电源,铜片质量变化128g,则Y一空气燃料电池理论上消耗标准状况下的空气(设空气中氧气的体积含量为20%) L.
 查看习题详情和答案>>
查看习题详情和答案>>