摘要:在一烧杯中盛有100mL2mol/L的H2SO4溶液.同时有一表面光滑的塑料小球悬浮于溶液中央.向该烧杯里缓缓加入0.4mol/LBa(OH)2溶液至恰好完全反应.在此实验过程中 (1)烧杯里观察到的现象有: ① ② (2)写出反应过程式中的离子方程式: .
网址:http://m.1010jiajiao.com/timu3_id_352687[举报]
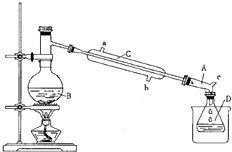 溴乙烷是一种重要的化工合成原料.实验室合成溴乙烷的反应和实验装置如下:
溴乙烷是一种重要的化工合成原料.实验室合成溴乙烷的反应和实验装置如下:反应:CH3CH2OH+BHr
| 浓H2SO4 |
装置如图.
实验中可能用到的数据如表:
| 物质 | 相对分子质量 | 沸点/℃ | 密度/g?cm-3 | 水溶性 |
| CH3CH2OH | 46 | 78.4 | 0.79 | 互溶 |
| CH3CH2Br | 109 | 38.4 | 1.42 | 难溶 |
| CH3CH2OCH2CH3 | 74 | 34.5 | 0.71 | 微溶 |
| CH2=CH2 | 28 | -103.7 | 0.38 | 不溶 |
| 浓硫酸(H2SO4) | 98 | 338 | 1.38 | 易溶 |
②分离提纯:将馏出物加水后振荡,再加入适量酸除去乙醚,分液,最后得到52mL溴乙烷.
回答下列问题:
(1)仪器B的名称是
(2)仪器C为直形冷凝管,冷水进口是
(3)仪器D置于盛有
(4)装置A的名称为牛角管,其结构中的c支管的作用是
(5)溴乙烷粗产品分离提纯阶段,加水的目的是
(6)该实验所得溴乙烷的产率为
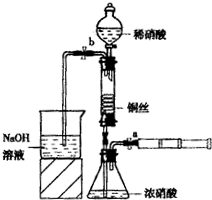 (2011?朝阳区二模)某同学利用下面装置实现铜与浓、稀硝酸反应,过程如下:
(2011?朝阳区二模)某同学利用下面装置实现铜与浓、稀硝酸反应,过程如下:Ⅰ、取一段铜丝,用稀硫酸除去铜锈〔主要成分是 Cu2(OH)2CO3〕
Ⅱ、将洗涤后的铜丝做成匝数很多的螺旋状
Ⅲ、按如图所示连接仪器、检查气密性、装入化学试剂
(1)过程Ⅰ发生反应的离子方程式是
Cu2(OH)2CO3+4H+=2Cu2++CO2↑+3H2O
Cu2(OH)2CO3+4H+=2Cu2++CO2↑+3H2O
;(2)过程Ⅱ将铜丝做成螺旋状的目的是
增大铜丝与酸的接触面积,提高化学反应速率
增大铜丝与酸的接触面积,提高化学反应速率
;(3)过程Ⅲ的后续操作如下:
①为使浓硝酸与铜丝接触,操作是
打开止水夹a和b,从注射器中推入空气
打开止水夹a和b,从注射器中推入空气
.当红棕色气体较多时,轻抽注射器使反应停止,关闭a,取下注射器.生成红棕色气体的化学方程式是Cu+4HNO3(浓)═Cu(NO3)2+2NO2↑+2H2O
Cu+4HNO3(浓)═Cu(NO3)2+2NO2↑+2H2O
.②控制b和分液漏斗活塞,玻璃管充满稀硝酸时,关闭b打开a,可见无色气体.稀硝酸充满玻璃管的实验目的是
将玻璃管中的NO2排出
将玻璃管中的NO2排出
.(4)将3支盛满红棕色气体的小试管分别倒置在盛有常温水、热水和冰水的3只烧杯中,发现液面上升的高度明显不一致.结果如下表所示:
| 实验编号 | 水温/0C | 液面上升高度 | ||
| 1 | 25 | 超过试管
| ||
| 2 | 50 | 不足试管
| ||
| 3 | 0 | 液面上升超过实验1 |
温度越低,进入试管中的溶液体积越多
温度越低,进入试管中的溶液体积越多
;②查阅资料:
a.NO2与水反应的实际过程为:2NO2+H2O═HNO2+HNO3 3HNO2═HNO3+2NO↑+H2O
b.HNO2不稳定.
产生上述现象的原因是
温度低,HNO2分解量减少,分解产生的NO气体量减少,且生成的NO所占体积小,所以进入试管中的溶液体积增大
温度低,HNO2分解量减少,分解产生的NO气体量减少,且生成的NO所占体积小,所以进入试管中的溶液体积增大
. 某同学利用下列装置实现铜与浓硝酸、稀硝酸反应,过程如图所示:
某同学利用下列装置实现铜与浓硝酸、稀硝酸反应,过程如图所示:I. 取一段铜丝,用稀硫酸除去铜锈[主要成分是Cu2(OH)2CO3].
Ⅱ.将洗涤后的铜丝做成匝数较多的螺旋状.
Ⅲ.按如图所示装置连接仪器、检查气密性、装入化学试剂.
(1)过程I发生反应的离子方程式是
Cu2(OH)2CO3+4H+═2Cu2++CO2↑+3H2O
Cu2(OH)2CO3+4H+═2Cu2++CO2↑+3H2O
.(2)写出过程Ⅲ中检查气密性的方法
打开b和a,关闭分液漏斗的活塞,将左边导管插入盛水的烧杯中,轻轻拉动注射器活塞,若导管中液面上升则说明气密性好
打开b和a,关闭分液漏斗的活塞,将左边导管插入盛水的烧杯中,轻轻拉动注射器活塞,若导管中液面上升则说明气密性好
.(3)过程Ⅲ的后续操作如下:
①打开止水夹a和b,轻推注射器,使浓硝酸与铜丝接触,观察到的现象是
产生红棕色气体
产生红棕色气体
,一段时间后使反应停止的操作是轻轻将注射器活塞向右拉使铜丝和溶液分开
轻轻将注射器活塞向右拉使铜丝和溶液分开
,关闭a,取下注射器.②打开b和分液漏斗活塞,当玻璃管充满稀硝酸后,关闭b和分液漏斗活塞,打开a,观察到有气泡产生.稀硝酸充满玻璃管的实验目是
将玻璃管中的NO2和空气排出
将玻璃管中的NO2和空气排出
,该反应的离子方程式是3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
.(4)另取3支盛满NO2气体的小试管分别倒置在盛有常温水、热水和冰水的3只烧杯中,发现液面上升的高度明显不一致.结果如表所示(忽略温度对气体体积的影响):
| 实验编号 | 水温/℃ | 液面上升高度 | ||
| 1 | 25 | 超过试管的
| ||
| 2 | 50 | 不足试管的
| ||
| 3 | 0 | 液面上升超过实验1 |
低
低
(填“高”或“低”),进入试管中的溶液越多.②查阅资料:
a.NO2与水反应的实际过程为:2NO2+H2O=HNO3+HNO2 3HNO2=HNO3+2NO↑+H2O;
b.HNO2不稳定.
则产生上述现象的原因是
温度低,HNO2分解量减少,分解产生的NO气体量减少,所以进入试管的溶液多
温度低,HNO2分解量减少,分解产生的NO气体量减少,所以进入试管的溶液多
.SnCl4的制备需分两步进行:第一步是金属Sn的制备,第二步由Sn和Cl2反应生成SnCl4.
第一步:金属Sn的制备--以锡石SnO2为原料,用足量的焦炭作还原剂,在高温下可制得粗锡,该反应的化学方程式为
已知锡与碳同族,粗锡经电解精炼可得纯锡,精炼时的阴极反应式为
第二步:SnCl4的制备--用干燥、纯净的Cl2与熔融的Sn反应制SnCl4,同时放出大量的热.已知SnCl4常温下是无色液体,沸点114℃,遇潮湿空气便发生水解反应,Sn的熔点:231℃,如图1是制取SnCl4的实验装置.

试回答以下问题:
(1)本试验中检查制气装置A气密性的方法是
装置A中反应的化学方程式为
(2)装置B、C中的药品名称分别是
(3)当反应生成SnCl4时,应熄灭
(4)老师说该实验装置E设计仍不完整,请你协助该研究小组设计出所缺装置(须标出试剂的名称,装置图尽可能简单)并在图2的方框中画出.
(5)实验制得的SnCl4中因溶解了Cl2而略显黄色.提纯SnCl4的方法是
查看习题详情和答案>>
第一步:金属Sn的制备--以锡石SnO2为原料,用足量的焦炭作还原剂,在高温下可制得粗锡,该反应的化学方程式为
SnO2+2C
Sn+2CO
| ||
SnO2+2C
Sn+2CO
.
| ||
已知锡与碳同族,粗锡经电解精炼可得纯锡,精炼时的阴极反应式为
Sn2++2eˉ=Sn
Sn2++2eˉ=Sn
.第二步:SnCl4的制备--用干燥、纯净的Cl2与熔融的Sn反应制SnCl4,同时放出大量的热.已知SnCl4常温下是无色液体,沸点114℃,遇潮湿空气便发生水解反应,Sn的熔点:231℃,如图1是制取SnCl4的实验装置.

试回答以下问题:
(1)本试验中检查制气装置A气密性的方法是
将A右端导管放人盛有水的烧杯中,微热烧瓶导管口出现气泡,冷却导管中出现一段稳定水柱
将A右端导管放人盛有水的烧杯中,微热烧瓶导管口出现气泡,冷却导管中出现一段稳定水柱
.装置A中反应的化学方程式为
MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O
| ||
MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O
.
| ||
(2)装置B、C中的药品名称分别是
饱和食盐水
饱和食盐水
、浓硫酸
浓硫酸
.(3)当反应生成SnCl4时,应熄灭
D
D
处的酒精灯,理由是依靠反应放出的热量维持SnCl4的生成
依靠反应放出的热量维持SnCl4的生成
.(4)老师说该实验装置E设计仍不完整,请你协助该研究小组设计出所缺装置(须标出试剂的名称,装置图尽可能简单)并在图2的方框中画出.
(5)实验制得的SnCl4中因溶解了Cl2而略显黄色.提纯SnCl4的方法是
蒸馏
蒸馏
. 实验室用图装置制取少量溴苯,回答下列问题.
实验室用图装置制取少量溴苯,回答下列问题.(1)在烧瓶a中装的试剂是
苯、溴、三溴化铁
苯、溴、三溴化铁
,反应的化学方程式是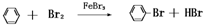
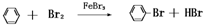
(2)跟烧瓶口垂直的一段长导管的作用是
导气和冷凝反应物的作用;
导气和冷凝反应物的作用;
.(3)C中盛放CCl4的作用是
吸收HBr中的溴蒸汽
吸收HBr中的溴蒸汽
.(4)生成的溴苯因溶有未反应的溴而显褐色,提纯的方法是
将溶有溴的溴苯倒入盛有NaOH溶液的烧杯中,振荡,溴苯的密度大于水,沉在下层,用分液漏斗分离出溴苯.
将溶有溴的溴苯倒入盛有NaOH溶液的烧杯中,振荡,溴苯的密度大于水,沉在下层,用分液漏斗分离出溴苯.
.(5)能证明苯和液溴发生的是取代反应,而不是加成反应,可向锥形瓶C中加入AgNO3溶液,若
生成淡黄色沉淀
生成淡黄色沉淀
,则能证明.另一种验证的方法是向锥形瓶C中加入石蕊试液
石蕊试液
,现象是溶液变红色.
溶液变红色.
.(6)实验结束时,将氢氧化钠溶液倒入烧瓶中,充分振荡,目的是
除去溶于溴苯中的溴
除去溶于溴苯中的溴
,写出有关的化学方程式Br2+2NaOH=NaBr+NaBrO+H2O
Br2+2NaOH=NaBr+NaBrO+H2O
.