题目内容
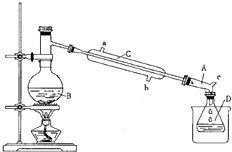 溴乙烷是一种重要的化工合成原料.实验室合成溴乙烷的反应和实验装置如下:
溴乙烷是一种重要的化工合成原料.实验室合成溴乙烷的反应和实验装置如下:反应:CH3CH2OH+BHr
| 浓H2SO4 |
装置如图.
实验中可能用到的数据如表:
| 物质 | 相对分子质量 | 沸点/℃ | 密度/g?cm-3 | 水溶性 |
| CH3CH2OH | 46 | 78.4 | 0.79 | 互溶 |
| CH3CH2Br | 109 | 38.4 | 1.42 | 难溶 |
| CH3CH2OCH2CH3 | 74 | 34.5 | 0.71 | 微溶 |
| CH2=CH2 | 28 | -103.7 | 0.38 | 不溶 |
| 浓硫酸(H2SO4) | 98 | 338 | 1.38 | 易溶 |
②分离提纯:将馏出物加水后振荡,再加入适量酸除去乙醚,分液,最后得到52mL溴乙烷.
回答下列问题:
(1)仪器B的名称是
(2)仪器C为直形冷凝管,冷水进口是
(3)仪器D置于盛有
(4)装置A的名称为牛角管,其结构中的c支管的作用是
(5)溴乙烷粗产品分离提纯阶段,加水的目的是
(6)该实验所得溴乙烷的产率为
分析:(1)根据仪器B的构造进行解答;
(2)冷凝管的通水方向为逆向通水,据此进行解答;
(3)根据溴乙烷沸点较低,难溶于水进行分析;
(4)牛角管上的c支管可以起到平衡气压的作用;
(5)乙醇沸点较低,生成的溴乙烷中会混有杂质乙醇,加水的目的是除去杂质乙醇;
(6)根据乙醇的体积计算出理论上生成溴乙烷的物质的量,然后根据实际产生的溴乙烷的量计算出产率.
(2)冷凝管的通水方向为逆向通水,据此进行解答;
(3)根据溴乙烷沸点较低,难溶于水进行分析;
(4)牛角管上的c支管可以起到平衡气压的作用;
(5)乙醇沸点较低,生成的溴乙烷中会混有杂质乙醇,加水的目的是除去杂质乙醇;
(6)根据乙醇的体积计算出理论上生成溴乙烷的物质的量,然后根据实际产生的溴乙烷的量计算出产率.
解答:解:(1)根据图示装置可知,仪器B为蒸馏烧瓶,
故答案为:蒸馏烧瓶;
(2)为了提高冷凝效果,冷凝管中通水方向采用逆向通水的方法,即从b进水,从a出水,
故答案为:b;
(3)根据表中数据可知,溴乙烷的沸点为38.4℃,且难溶于水,所以使用冰水冷却溴乙烷,
故答案为:冰水混合物;冷却溴乙烷;
(4)若没有支管c,装置D中气压偏大,不利于装置D接收馏出液,所以支管c的作用为:平衡装置B、D中的气压,便于装置D中接收馏出液,
故答案为:平衡装置B、D中的气压,便于装置D中接收馏出液;
(5)制取的溴乙烷中会混有乙醇,根据溴乙烷难溶于水,而乙醇易溶于水,可以加水振荡后除去溴乙烷中溶解的乙醇,
故答案为:除去溶解在溴乙烷中乙醇;
(6)50mL乙醇的质量为:0.79g/mL×50mL=39.5g,乙醇的物质的量为:
≈0.86mol,根据反应原理可知,理论上生成溴乙烷的物质的量为0.86mol;
52mL溴乙烷的物质的量为:
≈0.68mol,溴乙烷的产率为:
×100%≈79%,
故答案为:79%.
故答案为:蒸馏烧瓶;
(2)为了提高冷凝效果,冷凝管中通水方向采用逆向通水的方法,即从b进水,从a出水,
故答案为:b;
(3)根据表中数据可知,溴乙烷的沸点为38.4℃,且难溶于水,所以使用冰水冷却溴乙烷,
故答案为:冰水混合物;冷却溴乙烷;
(4)若没有支管c,装置D中气压偏大,不利于装置D接收馏出液,所以支管c的作用为:平衡装置B、D中的气压,便于装置D中接收馏出液,
故答案为:平衡装置B、D中的气压,便于装置D中接收馏出液;
(5)制取的溴乙烷中会混有乙醇,根据溴乙烷难溶于水,而乙醇易溶于水,可以加水振荡后除去溴乙烷中溶解的乙醇,
故答案为:除去溶解在溴乙烷中乙醇;
(6)50mL乙醇的质量为:0.79g/mL×50mL=39.5g,乙醇的物质的量为:
| 39.5g |
| 46g/mol |
52mL溴乙烷的物质的量为:
| 1.42g/mL×52mL |
| 109g/mol |
| 0.68mol |
| 0.86mol |
故答案为:79%.
点评:本题考查了溴乙烷的制取方法,题目难度中等,涉及了仪器构造及使用方法、物质的提纯与除杂、化学计算等知识考查,注意掌握溴乙烷的制取原理,(6)为易错点,注意溴乙烷产率的计算方法.

练习册系列答案
相关题目
 溴乙烷是一种重要的有机化工原料,制备溴乙烷的原料有95%乙醇、80%硫酸(用蒸馏水稀释浓硫酸)、研细的溴化钠粉末和几粒碎瓷片,该反应的原理如下:
溴乙烷是一种重要的有机化工原料,制备溴乙烷的原料有95%乙醇、80%硫酸(用蒸馏水稀释浓硫酸)、研细的溴化钠粉末和几粒碎瓷片,该反应的原理如下:NaBr+H2SO4→NaHSO4+HBr
CH3CH2OH+HBr
| 硫酸 |
某课外小组欲在实验室制备溴乙烷的装置如图.数据如表.
| 物质 数据 |
乙醇 | 溴乙烷 | 1,2-二溴乙烷 | 乙醚 | 浓硫酸 |
| 密度/g?cm-3 | 0.79 | 1.46 | 2.2 | 0.71 | 1.84 |
| 熔点(℃) | -130 | -119 | 9 | -116 | 10 |
| 沸点(℃) | 78.5 | 38.4 | 132 | 34.6 | 338 |
| 在水中的溶解度(g/100g水) | 互溶 | 0.914 | 1 | 7.5 | 互溶 |
(1)加入药品之前须做的操作是:
(2)装置B的作用是除了使溴乙烷馏出,还有一个目的是
(3)反应时有可能生成SO2和一种红棕色气体,可选择氢氧化钠溶液除去该气体,有关的离子方程式是
(4)实验中采用80%硫酸,而不能用98%浓硫酸,一方面是为了减少副反应,另一方面是为了
(5)粗产品中含有的主要有机液体杂质是
 溴乙烷是一种重要的有机化工原料,其沸点为38.4℃.制备溴乙烷的一种方法是乙醇与氢溴酸反应,该反应的化学方程式是
溴乙烷是一种重要的有机化工原料,其沸点为38.4℃.制备溴乙烷的一种方法是乙醇与氢溴酸反应,该反应的化学方程式是
 生成,同时观察到还有一种红棕色气体产生,该气体物质的电子式是
。
生成,同时观察到还有一种红棕色气体产生,该气体物质的电子式是
。 ,然后进行的实验操作是
(填写正确选项的字母)。
,然后进行的实验操作是
(填写正确选项的字母)。 溶液 ③加入稀
溶液 ③加入稀 酸化
④加入NaOH溶液
酸化
④加入NaOH溶液