网址:http://m.1010jiajiao.com/timu3_id_352404[举报]
(1)实验室制取氯气也可用下图装置

①实验原理(写化学方程式):______________________________。
②收集原理:因Cl2溶于水,密度比空气大,故用向上排空气法;因Cl2在饱和食盐水中的溶解度小,故可用排饱和食盐水法收集。A、B为两个位置上的止水夹,采用向上排空气法和排饱和食盐水法收集Cl2时的正确操作是_________________________________________。
A.采用向上排空气法收集Cl2时应将A关闭,B打开
B.采用向上排空气法收集Cl2时应将B关闭,A打开
C.采用排饱和食盐水法收集Cl2时应将A关闭,B打开
D.采用排饱和食盐水法收集Cl2时应将B关闭,A打开
③尾气处理,氢氧化钠溶液的作用是处理尾气,防止氯气污染空气,该反应的离子方程式为:__________________________________________________________________。
(2)科学研究中可以用多种方法来测定阿伏加德罗常数。X射线衍射法就是其中的一种。X射线法是通过X射线衍射仪测出离子化合物离子间的间隔,再根据该化合物质量与体积的关系(密度)来确定。已知:X射线衍射仪测出的NaCl晶体中相邻钠离子与氯离子间距为a cm,NaCl相对分子质量为b。某同学为了测定阿伏加德罗常数,做了如下实验:用分析天平称取一定质量研细的NaCl固体,装入25 mL容量瓶中,然后用滴定管向容量瓶中滴加苯并不断振荡,使苯、氯化钠晶体充分混匀,标定,其实验结果如下表:
实验序号 | m NaCl/g | 消耗苯体积/cm3 | VNaCl | NA |
1 | 5.879 3 | 22.27 |
|
|
2 | 9.456 6 | 20.67 |
|
|
根据实验数据,请填写第一次实验中的空格(阿伏加德罗常数项只要求写出计算式,对原始数据不进行处理)。
查看习题详情和答案>> (I)滴定分析法是化学分析法中的重要分析方法之一.
(I)滴定分析法是化学分析法中的重要分析方法之一.(一)用酸碱中和滴定法测定市售白醋的总酸量(g/100mL).
A.实验步骤:
(1)用酸式滴定管量取10.00mL食用白醋,在烧杯中用水稀释后转移到100mL容量瓶中定容,摇匀即得待测白醋溶液.
(2)用酸式滴定管取待测白醋溶液20.00mL于锥形瓶中,向其中滴加2滴酚酞作指示剂.
(3)读取盛装0.1000mol/L NaOH 溶液的碱式滴定管的初始读数.如果液面位置如图所示,则此时的读数为
(4)滴定.当
停止滴定,并记录NaOH溶液的终读数.重复滴定3次.
B.实验记录
| 滴定次数 实验数据(mL) |
1 | 2 | 3 | 4 |
| V(样品) | 20.00 | 20.00 | 20.00 | 20.00 |
| V(NaOH)(消耗) | 15.95 | 15.00 | 15.05 | 14.95 |
(1)经计算,市售白醋总酸量=
(2)在本实验的滴定过程中,下列操作会使实验结果偏大的是
a.碱式滴定管在滴定时未用标准NaOH溶液润洗
b.碱式滴定管的尖嘴在滴定前无气泡,滴定后有气泡
c.锥形瓶中加入待测白醋溶液后,再加少量水
d.锥形瓶在滴定时剧烈摇动,有少量液体溅出
(二)用双指示剂法测定纯碱的含量
如图的滴定曲线表示:用0.1000mol/L HCl滴定 20.00ml 0.1000mol/L Na2CO3

①A处选用
②当滴定至混合液pH接近4时,为了防止终点出现过早,减少实验误差,应剧烈摇动溶液或加热一会溶液,冷却后再继续滴定,这样做的理由是:
(II)由于MnO2能作H2O2溶液分解的催化剂,某校化学兴趣小组想探究其他一些金属氧物质是否也可以作H2O2溶液分解的催化剂?探究过程如下.
(1)[猜想]:Al2O3能作过氧化氢分解的催化剂.
(2)[实验验证]:
| 实验步骤 | 实验现象 | 实验结论 | |
| 实验一 | 将带火星的木条伸入装有过氧化氢溶液的试管中 | 木条不复燃 | 常温下过氧化氢溶液不分解(或分解很少) ? ? |
| 实验二 | 在装有H2O2溶液的试管中加入少量Al2O3,然后将带火星的木条伸入试管中 | 木条复燃 | Al2O3能加快H2O2溶液的分解速率 Al2O3能加快H2O2溶液的分解速率 |
(4)[讨论与反思]:有的同学认为只有上述两个实验,不能完全证明Al2O3在H2O2溶液分解中起了催化作用.还应补充实验来验证:
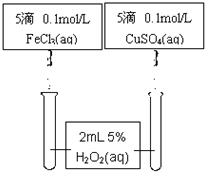
(5)另外化学兴趣小组为比较Fe3+和Cu2+对H2O2分解的催化效果,该组同学设计了如图所示的实验.可通过观察反应产生气泡快慢或反应完成的先后或试管壁的冷热程度定性比较得出结论.有同学提出将CuSO4改为CuCl2更为合理,其理由是

(一)用酸碱中和滴定法测定市售白醋的总酸量(g/100mL).
A.实验步骤:
(1)用酸式滴定管量取10.00mL食用白醋,在烧杯中用水稀释后转移到100mL容量瓶中定容,摇匀即得待测白醋溶液.
(2)用酸式滴定管取待测白醋溶液20.00mL于锥形瓶中,向其中滴加2滴酚酞作指示剂.
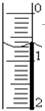
(3)读取盛装0.1000mol/L NaOH 溶液的碱式滴定管的初始读数.如果液面位置如图所示,则此时的读数为______.
(4)滴定.当______时,
停止滴定,并记录NaOH溶液的终读数.重复滴定3次.
B.实验记录
| 滴定次数 实验数据(mL) |
1 | 2 | 3 | 4 |
| V(样品) | 20.00 | 20.00 | 20.00 | 20.00 |
| V(NaOH)(消耗) | 15.95 | 15.00 | 15.05 | 14.95 |
(1)经计算,市售白醋总酸量=______g/100mL.
(2)在本实验的滴定过程中,下列操作会使实验结果偏大的是______(填写序号).
a.碱式滴定管在滴定时未用标准NaOH溶液润洗
b.碱式滴定管的尖嘴在滴定前无气泡,滴定后有气泡
c.锥形瓶中加入待测白醋溶液后,再加少量水
d.锥形瓶在滴定时剧烈摇动,有少量液体溅出
(二)用双指示剂法测定纯碱的含量
如图的滴定曲线表示:用0.1000mol/L HCl滴定 20.00ml 0.1000mol/L Na2CO3

①A处选用______作指示剂比较合适;
②当滴定至混合液pH接近4时,为了防止终点出现过早,减少实验误差,应剧烈摇动溶液或加热一会溶液,冷却后再继续滴定,这样做的理由是:______.
(II)由于MnO2能作H2O2溶液分解的催化剂,某校化学兴趣小组想探究其他一些金属氧物质是否也可以作H2O2溶液分解的催化剂?探究过程如下.
(1)[猜想]:Al2O3能作过氧化氢分解的催化剂.
(2)[实验验证]:
| 实验步骤 | 实验现象 | 实验结论 | |
| 实验一 | 将带火星的木条伸入装有过氧化氢溶液的试管中 | 木条不复燃 | 常温下过氧化氢溶液不分解(或分解很少)______ |
| 实验二 | 在装有H2O2溶液的试管中加入少量Al2O3,然后将带火星的木条伸入试管中 | 木条复燃 | ______ |
(4)[讨论与反思]:有的同学认为只有上述两个实验,不能完全证明Al2O3在H2O2溶液分解中起了催化作用.还应补充实验来验证:______.
(5)另外化学兴趣小组为比较Fe3+和Cu2+对H2O2分解的催化效果,该组同学设计了如图所示的实验.可通过观察反应产生气泡快慢或反应完成的先后或试管壁的冷热程度定性比较得出结论.有同学提出将CuSO4改为CuCl2更为合理,其理由是______,你认为还可以作何改进?______.
(一)用酸碱中和滴定法测定市售白醋的总酸量(g/100mL).
A.实验步骤:
(1)用酸式滴定管量取10.00mL食用白醋,在烧杯中用水稀释后转移到100mL容量瓶中定容,摇匀即得待测白醋溶液.
(2)用酸式滴定管取待测白醋溶液20.00mL于锥形瓶中,向其中滴加2滴酚酞作指示剂.
(3)读取盛装0.1000mol/L NaOH 溶液的碱式滴定管的初始读数.如果液面位置如图所示,则此时的读数为______.
(4)滴定.当______时,
停止滴定,并记录NaOH溶液的终读数.重复滴定3次.
B.实验记录
| 滴定次数 实验数据(mL) | 1 | 2 | 3 | 4 |
| V(样品) | 20.00 | 20.00 | 20.00 | 20.00 |
| V(NaOH)(消耗) | 15.95 | 15.00 | 15.05 | 14.95 |
(1)经计算,市售白醋总酸量=______g/100mL.
(2)在本实验的滴定过程中,下列操作会使实验结果偏大的是______(填写序号).
a.碱式滴定管在滴定时未用标准NaOH溶液润洗
b.碱式滴定管的尖嘴在滴定前无气泡,滴定后有气泡
c.锥形瓶中加入待测白醋溶液后,再加少量水
d.锥形瓶在滴定时剧烈摇动,有少量液体溅出
(二)用双指示剂法测定纯碱的含量
如图的滴定曲线表示:用0.1000mol/L HCl滴定 20.00ml 0.1000mol/L Na2CO3

①A处选用______作指示剂比较合适;
②当滴定至混合液pH接近4时,为了防止终点出现过早,减少实验误差,应剧烈摇动溶液或加热一会溶液,冷却后再继续滴定,这样做的理由是:______.
(II)由于MnO2能作H2O2溶液分解的催化剂,某校化学兴趣小组想探究其他一些金属氧物质是否也可以作H2O2溶液分解的催化剂?探究过程如下.
(1)[猜想]:Al2O3能作过氧化氢分解的催化剂.
(2)[实验验证]:
| 实验步骤 | 实验现象 | 实验结论 | |
| 实验一 | 将带火星的木条伸入装有过氧化氢溶液的试管中 | 木条不复燃 | 常温下过氧化氢溶液不分解(或分解很少)______ |
| 实验二 | 在装有H2O2溶液的试管中加入少量Al2O3,然后将带火星的木条伸入试管中 | 木条复燃 | ______ |
(4)[讨论与反思]:有的同学认为只有上述两个实验,不能完全证明Al2O3在H2O2溶液分解中起了催化作用.还应补充实验来验证:______.
(5)另外化学兴趣小组为比较Fe3+和Cu2+对H2O2分解的催化效果,该组同学设计了如图所示的实验.可通过观察反应产生气泡快慢或反应完成的先后或试管壁的冷热程度定性比较得出结论.有同学提出将CuSO4改为CuCl2更为合理,其理由是______,你认为还可以作何改进?______.

 查看习题详情和答案>>
查看习题详情和答案>>
铜是人类最早生产和使用的金属之一,在化学反应中铜元素可表现为0、+1、+2价。
Ⅰ.(1)在西汉古籍中曾有记载:“曾青得铁则化为铜”,即:曾青(CuSO4)跟铁反应生成铜,试写出该反应的离子方程式 。
(2)在原电池和电解池中,铜常用作电极,下列有关说法正确的是
| A.锌铜原电池中铜是正极 | B.用电解法精炼铜时粗铜作阴极 |
| C.在镀件上镀铜时铜与电源正极相连 | D.铜作阳极时不一定溶解 |
【提出问题】碳酸钙受热分解生成CaO和CO2,那么无水硫酸铜受热分解也只生成CuO和SO3吗?
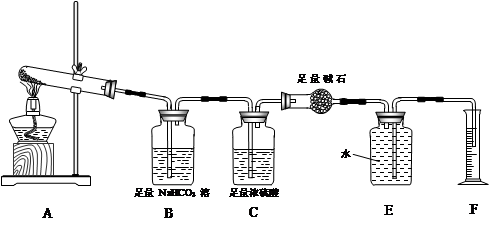
【设计实验】按如图装置进行试验。
|
 【实验过程】
【实验过程】a.准确称取无水硫酸铜2.40g于装置A试管中加热,直至固体全部变为黑色,经验证该黑色粉末为CuO。
b.实验中,观察到装置E中的水部分被排入量筒中;实验结束后,测得量筒中水的体积为112mL(已折算成标准状态下气体的体积),并测得干燥管D的质量增加了1.32g。
(3)装置C的作用 。
(4)根据装置E、F中现象,推测还有气体 (填分子式)生成;实验生成的SO3为 mol。(5)装置A中反应的化学方程式为 。
【实验结论】无水硫酸铜受热分解不仅仅生成CuO和SO3。
【反思与评价】
(6)任何实验都存在误差,请指出本实验中可能造成误差的因素是 (任写2点)。 查看习题详情和答案>>