摘要:a g纯Na2CO3和a g含NaHCO3的Na2CO3相比.下列各种情况描述正确的是 ( ) A.分别和盐酸反应时.混合物的耗酸量大 B.分别和足量酸反应时.混合物放出CO2多 C.分别配成等体积的溶液.混合物PH值大 D.分别配成等体积的溶液.混合物[Na+]大
网址:http://m.1010jiajiao.com/timu3_id_351905[举报]
 四川盛产井盐,由井盐提取的食盐是日常生活必需品,也是重要的化工原料.
四川盛产井盐,由井盐提取的食盐是日常生活必需品,也是重要的化工原料.(1)某种粗盐含有少量Ca2+、Mg2+、Fe3+、SO
2- 4 |
粗盐溶解
| 加入试剂 |
| 过滤 |
| 适量盐酸 |
| 蒸发、结晶、烘干 |
提供的试剂有:a.饱和Na2CO3溶液 b.饱和K2CO3溶液
c.NaOH溶液 e.Ba(NO3)2溶液 d.BaCL2溶液
①欲除去粗盐溶液中的Ca2+、Mg2+、Fe3+、SO
2- 4 |
dca(或dac,或cda)
dca(或dac,或cda)
②蒸发时所用玻璃棒的作用是
搅拌,防止液体飞溅
搅拌,防止液体飞溅
,蒸发操作即将结束,当溶液中有大量晶体析出
溶液中有大量晶体析出
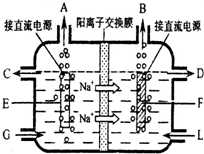
时,停止加热,熄灭酒精灯.(2)食盐是工业上生产氯气和烧碱的重要原料.右图是工业上电解饱和和食盐水的离子交换膜电解槽示意图(阳极用金属钛网制成,阴极由碳钢网制成).
①B处出口产生的物质是
H2
H2
;G处进口的物质是精制的饱和食盐水
精制的饱和食盐水
.电解总反应的离子方程式为2Cl-+2H2O
Cl2↑+H2↑+2OH-
| ||
2Cl-+2H2O
Cl2↑+H2↑+2OH-
.
| ||
②如果开始就将直流电源的正负极与电极接反了,通电几分钟,在电极F附近可以观察到的现象是
溶液中产生白色沉淀,随后沉淀变为灰绿色,甚至变为红褐色,碳钢网电极被腐蚀
溶液中产生白色沉淀,随后沉淀变为灰绿色,甚至变为红褐色,碳钢网电极被腐蚀
.(3)采用无膜电解槽电解饱和食盐水(离子交换膜更换为搅拌器),可制取次氯酸钠溶液作消毒液.实验室在常温下电解饱和食盐水v1mL(密度为ρg/cm3),当收集到v2L标准状况下的H2时,理论上所得混合溶液中次氯酸钠的质量分数计算式为
| ||
ρV1-
|
| ||
ρV1-
|
下列有关说法正确的是( )
| A、反应NH3(g)+HCl(g)═NH4Cl(s)在室温下可自发进行,则该反应的△H<0 | ||
| B、电解法精炼铜时,以粗铜作阴极,纯铜作阳极 | ||
C、CH3COOH溶液加水稀释后,溶液中
| ||
| D、Na2CO3溶液中加入少量Ca(OH)2 固体,CO32-水解程度减小,溶液的pH减小 |
某不纯的烧碱样品,含Na2CO3 3.8%(质量百分含量)、H2O 5.8%、NaHCO3 0.004%.取m g样品溶于40mL 2mol?L-1的盐酸后,并用 2mol?L-1 NaOH溶液中和剩余的酸,在蒸发后可得干燥的固体的质量为( )
查看习题详情和答案>>
(2012?唐山三模)(1)常温下,浓度均为0.1mol/L的6种溶液的pH如下表:
①上述溶液中的阴离子结合H+能力最弱的为
②结合表中数据分析,与0.1mol/L的CH3OONa溶液中水的电离程度相同的是(填字母代号)
A.pH=8.8的NaOH溶液
B.pH=5.2的NH4Cl溶液
C.pH=5.2的盐酸
D.0.1mol/L的NaCN溶液
E.pH=8.8的Na2CO3溶液
F.0.1mol/L的CH3COONH4溶液
③将浓度均为0.1mol/L的b、c等体积混合,所得溶液中各离子浓度由大到小的顺序为
④100℃时纯水中c(H+)=10-6mol/L,在此温度下某浓度的e溶液的pH=n,则c(H+)+c(HCN)
(2)已知2CH3OH(g)?CH3OCH3(g)+H2O(g)△H=-25KJ/mol,则该反应的化学平衡常数K的表达式为
若某温度下K=400,在1L密闭容器中加入CH3OH,反应到t时刻,各组分浓度如下:
①判断下列说法正确的是
A.增大压强,可以提高CH3OH的转化率
B.平衡时再向容器中加入CH3OCH3和水蒸气各1mol,平衡不移动
C.平衡后升高温度,K>400
D.平衡时再加入与起始等量的CH3OH,达新平衡后,CH3OH转化率不变
②达平衡时体系总能量减少
查看习题详情和答案>>
| 序号 | a | b | c | d | e | f |
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5Na |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
CH3COO-
CH3COO-
,d溶液呈碱性的原因是ClO-+H2O?HClO+OH-
ClO-+H2O?HClO+OH-
(用离子方程式表示).②结合表中数据分析,与0.1mol/L的CH3OONa溶液中水的电离程度相同的是(填字母代号)
BE
BE
.A.pH=8.8的NaOH溶液
B.pH=5.2的NH4Cl溶液
C.pH=5.2的盐酸
D.0.1mol/L的NaCN溶液
E.pH=8.8的Na2CO3溶液
F.0.1mol/L的CH3COONH4溶液
③将浓度均为0.1mol/L的b、c等体积混合,所得溶液中各离子浓度由大到小的顺序为
c(Cl-)>c(H+)>c(NH4+)>c(OH-)
c(Cl-)>c(H+)>c(NH4+)>c(OH-)
.④100℃时纯水中c(H+)=10-6mol/L,在此温度下某浓度的e溶液的pH=n,则c(H+)+c(HCN)
10n-12
10n-12
mol/L.(2)已知2CH3OH(g)?CH3OCH3(g)+H2O(g)△H=-25KJ/mol,则该反应的化学平衡常数K的表达式为
K=
| c(CH3OCH3)?c(H2O) |
| c2(CH3OH) |
K=
.| c(CH3OCH3)?c(H2O) |
| c2(CH3OH) |
若某温度下K=400,在1L密闭容器中加入CH3OH,反应到t时刻,各组分浓度如下:
| 物质 | CH3OH | CHO3CH3 | H2O |
| 浓度/mol/L | 0.8 | 1.24 | 1.24 |
D
D
(填字母代号).A.增大压强,可以提高CH3OH的转化率
B.平衡时再向容器中加入CH3OCH3和水蒸气各1mol,平衡不移动
C.平衡后升高温度,K>400
D.平衡时再加入与起始等量的CH3OH,达新平衡后,CH3OH转化率不变
②达平衡时体系总能量减少
31
31
kJ.