题目内容
下列有关说法正确的是( )
| A、反应NH3(g)+HCl(g)═NH4Cl(s)在室温下可自发进行,则该反应的△H<0 | ||
| B、电解法精炼铜时,以粗铜作阴极,纯铜作阳极 | ||
C、CH3COOH溶液加水稀释后,溶液中
| ||
| D、Na2CO3溶液中加入少量Ca(OH)2 固体,CO32-水解程度减小,溶液的pH减小 |
分析:A、根据△G=△H-T△S<0,反应能自发进行判断;
B、电解法精炼铜时,阳极逐渐溶解,阴极析出Cu;
C、加水稀释促进CH3COOH的电离;
D、根据碳酸根的水解平衡移动分析.
B、电解法精炼铜时,阳极逐渐溶解,阴极析出Cu;
C、加水稀释促进CH3COOH的电离;
D、根据碳酸根的水解平衡移动分析.
解答:解:A、当△G=△H-T△S<0,反应能自发进行,已知反应NH3(g)+HCl(g)═NH4Cl(s)在室温下可自发进行,该反应为△G<0的反应,所以反应的△H<0,故A正确;
B、电解法精炼铜时,阳极逐渐溶解,则粗铜作阳极,阴极析出Cu,纯铜作阴极,故B错误;
C、加水稀释促进CH3COOH的电离,所以CH3COOH溶液加水稀释后,n(CH3COOH)减少,则溶液中
的值减小,故C错误;
D、Na2CO3溶液中存在碳酸根的水解平衡,加入Ca(OH)2 固体,钙离子与碳酸根离子结合生成碳酸钙沉淀,碳酸根的水解平衡逆移,CO32-水解程度减小,加Ca(OH)2 固体溶液中氢氧根离子浓度增大,所以pH增大,故D错误;
故选A.
B、电解法精炼铜时,阳极逐渐溶解,则粗铜作阳极,阴极析出Cu,纯铜作阴极,故B错误;
C、加水稀释促进CH3COOH的电离,所以CH3COOH溶液加水稀释后,n(CH3COOH)减少,则溶液中
| c(CH3COOH) |
| c(CH3COO-) |
D、Na2CO3溶液中存在碳酸根的水解平衡,加入Ca(OH)2 固体,钙离子与碳酸根离子结合生成碳酸钙沉淀,碳酸根的水解平衡逆移,CO32-水解程度减小,加Ca(OH)2 固体溶液中氢氧根离子浓度增大,所以pH增大,故D错误;
故选A.
点评:本题考查了反应自发性的判断、电解原理的应用、弱酸的电离、盐的水解等,题目注意涉及了反应原理的应用,题目难度不大,注意对有关原理的准确把握.

练习册系列答案
相关题目
 (2012?绵阳模拟)钾在氧气中燃烧时得到一种钾的氧化物晶体,其结构如图所示,下列有关说法正确的是( )
(2012?绵阳模拟)钾在氧气中燃烧时得到一种钾的氧化物晶体,其结构如图所示,下列有关说法正确的是( )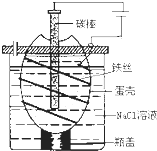 工业上通过电解饱和氯化钠溶液的方法获得氢氧化钠和氯气,图为某实验小组自制的电解饱和食盐水的简易装置,
工业上通过电解饱和氯化钠溶液的方法获得氢氧化钠和氯气,图为某实验小组自制的电解饱和食盐水的简易装置,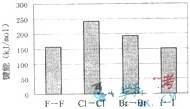 (2009?上海)海洋是资源的宝库,蕴藏着丰富的化学元素,如氯、溴、碘等.
(2009?上海)海洋是资源的宝库,蕴藏着丰富的化学元素,如氯、溴、碘等.