摘要:(四)化学平衡的标志 1.等速标志:v正=v逆 指反应体系中的同一种物质来表示的正反应速率和逆反应速率相等.对不同种物质而言.速率不一定相等. 何谓“v正=v逆 ?如何理解? 以N2+3H2 2NH3 反应为例 单位时间.单位体积内 ①若有1mol N2消耗.则有1mol N2生成(同种物质.物质的量相等.词性相反) ②若有1mol N2消耗.则有3mol H2生成(同侧不同种物质.物质的量之比=系数对应比.词性相反.) ③若有1mol N2消耗.则有2mol NH3消耗(异侧物质.物质的量之比=对应系数比.词性相同) ④若有1mol N≡N键断裂,则有6mol N-H键断裂 注意 对象 词性 同种(侧)物质 相反 异侧物质 相同 2.百分含量不变标志 正因为v正=v逆≠0.所以同一瞬间同一物质的生成量等于消耗量.总的结果是混合体系中各组成成分的物质的量.质量.物质的量浓度.各成分的百分含量.转化率等不随时间变化而改变. 3.对于有气体参与的可逆反应 1)从反应混合气的平均相对分子质量()考虑 = 当△ng≠0, 一定时.则标志达平衡. 当△ng=0.为恒值.不论是否达平衡. 若有非气体参与:不论△ng是否等于0.则当一定时.可标志达平衡 实例: ① H2(g)+I2 △ng=0 ② SO2(g)+O2(g) 2SO3(g) △ng≠0 ③ C(s)+O2(g) CO2(g) △ng=0 ④ CO2 △ng≠0 在实例反应①中.总为恒值. 在反应②.③.④中.只要反应未达平衡.则不为定值.反之当为一定值.不随时间变化而变化时.则标志着达到平衡状态. 2)从气体密度考虑: = 恒容:总为恒值.不能作平衡标志 恒压: 当各成分均为气体时 △ng=0. 总为恒值.同上 △ng≠0. 为一定值时.则可作为标志 当有非气体物质参与时晨时 恒容:为一定值时.可作标志 恒压:△ng=0. 为一定值时.可作标志 3)从体系内部压强考虑: ∵恒容.恒温.n(g)越大,P越大 当 ∴不论各成分是否均为气 △ng=0.则P为恒值.不能作标志 体.只需考虑△ng. △ng≠0.则当P一定时.可作标志 4)从体系内部温度考虑 当化学平衡尚未建立或平衡发生移动时.反应总要放出或吸收热量. 若为绝热体系.当体系内温度一定时.则标志达到平衡.
网址:http://m.1010jiajiao.com/timu3_id_351068[举报]
天然气的主要成分是甲烷.在某平衡体系中存在CH4、H2O、CO、H2四种气体,其平衡常数表达式为k=
.已知温度、压强和水碳比[
]对甲烷转化反应的影响如图:
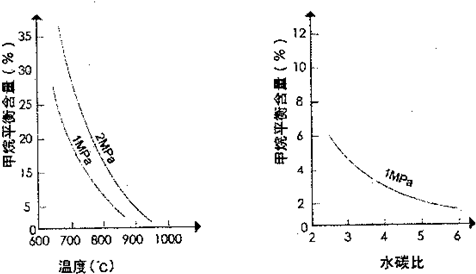
请回答下列问题:
(1)写出该可逆反应的化学方程式:
(2)根据图判断△H
(3)假设上述反应在恒容、恒温下进行,判断反应达到平衡状态时的标志是
A.CO减少的化学反应速率和H2O减少的化学反应速率相等
B.CO、H2O(g)、CH4、H2的浓度都相等
C.CO、H20(g)、CH4、H2的浓度都不再发生变化
D.正、逆反应速率都为零
(4)在图画出压强为2MPa时,CH4平衡含量与水碳比之间关系曲线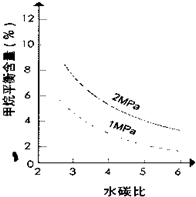
 .
.
查看习题详情和答案>>
| c(CO)?c3(H2) |
| c(CH4)?c(H2O) |
| n(H2O) |
| n(CH4) |

请回答下列问题:
(1)写出该可逆反应的化学方程式:
CH4(g)+H2O(g)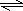 CO(g)+3H2(g)
CO(g)+3H2(g)
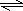 CO(g)+3H2(g)
CO(g)+3H2(g)CH4(g)+H2O(g) CO(g)+3H2(g)
CO(g)+3H2(g)
 CO(g)+3H2(g)
CO(g)+3H2(g)(2)根据图判断△H
>
>
0,△S>
>
0(选填“>”、“<”或“=”).(3)假设上述反应在恒容、恒温下进行,判断反应达到平衡状态时的标志是
AC
AC
A.CO减少的化学反应速率和H2O减少的化学反应速率相等
B.CO、H2O(g)、CH4、H2的浓度都相等
C.CO、H20(g)、CH4、H2的浓度都不再发生变化
D.正、逆反应速率都为零
(4)在图画出压强为2MPa时,CH4平衡含量与水碳比之间关系曲线


天然气的主要成分是甲烷。在某平衡体系中存在CH4、H2O、CO、H2四种气体,
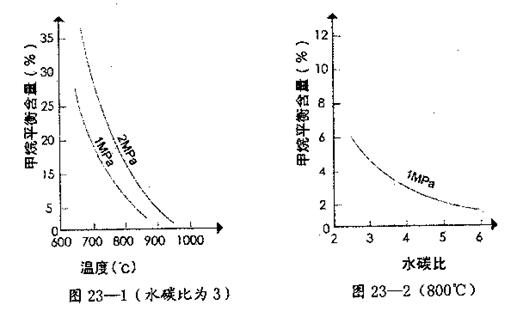
其平衡常数表达式为![]() 。已知温度、压强和水碳比[n(H2O)/n(CH4)]对甲烷转化反应的影响如下图:
。已知温度、压强和水碳比[n(H2O)/n(CH4)]对甲烷转化反应的影响如下图:
请回答下列问题:
(1)写出该可逆反应的化学方程式:
(2)根据图23—1判断△H 0,△S 0(选填“>”、“<”或“=”)。
(3)假设上述反应在恒容、恒温下进行,判断反应达到平衡状态时的标志是
A.CO减少的化学反应速率和H2O(曲减少的化学反应速率相等
B.CO、H2O(g)、CH4、H2的浓度都相等
C.CO、H20(g)、CH4、H2的浓度都不再发生变化
D.正、逆反应速率都为零
(4)在图23—2中画出压强为2 MPa时,CH4平衡含量与水碳比之间关系曲线。
查看习题详情和答案>>(10分)天然气的主要成分是甲烷。在某平衡体系中存在CH4、H2O、CO、H2四种气体,
其平衡常数表达式为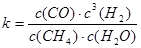 。已知温度、压强和水碳比[n(H2O)/n(CH4)]对甲烷转化反应的影响如下图:
。已知温度、压强和水碳比[n(H2O)/n(CH4)]对甲烷转化反应的影响如下图:
请回答下列问题:
(1)写出该可逆反应的化学方程式:
(2)根据图23—1判断△H 0,△S 0(选填“>”、“<”或“=”)。
(3)假设上述反应在恒容、恒温下进行,判断反应达到平衡状态时的标志是
| A.CO减少的化学反应速率和H2O(曲减少的化学反应速率相等 |
| B.CO、H2O(g)、CH4、H2的浓度都相等 |
| C.CO、H20(g)、CH4、H2的浓度都不再发生变化 |
| D.正、逆反应速率都为零 |
(10分)天然气的主要成分是甲烷。在某平衡体系中存在CH4、H2O、CO、H2四种气体,
其平衡常数表达式为 。已知温度、压强和水碳比[n(H2O)/n(CH4)]对甲烷转化反应的影响如下图:
。已知温度、压强和水碳比[n(H2O)/n(CH4)]对甲烷转化反应的影响如下图:

请回答下列问题:
(1)写出该可逆反应的化学方程式:
(2)根据图23—1判断△H 0,△S 0(选填“>”、“<”或“=”)。
(3)假设上述反应在恒容、恒温下进行,判断反应达到平衡状态时的标志是
(4)在图23—2中画出压强为2 MPa时,CH4平衡含量与水碳比之间关系曲线。
其平衡常数表达式为
 。已知温度、压强和水碳比[n(H2O)/n(CH4)]对甲烷转化反应的影响如下图:
。已知温度、压强和水碳比[n(H2O)/n(CH4)]对甲烷转化反应的影响如下图:
请回答下列问题:
(1)写出该可逆反应的化学方程式:
(2)根据图23—1判断△H 0,△S 0(选填“>”、“<”或“=”)。
(3)假设上述反应在恒容、恒温下进行,判断反应达到平衡状态时的标志是
| A.CO减少的化学反应速率和H2O(曲减少的化学反应速率相等 |
| B.CO、H2O(g)、CH4、H2的浓度都相等 |
| C.CO、H20(g)、CH4、H2的浓度都不再发生变化 |
| D.正、逆反应速率都为零 |
天然气的主要成分是甲烷.在某平衡体系中存在CH4、H2O、CO、H2四种气体,其平衡常数表达式为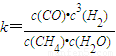 .已知温度、压强和水碳比[
.已知温度、压强和水碳比[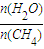 ]对甲烷转化反应的影响如图:
]对甲烷转化反应的影响如图:
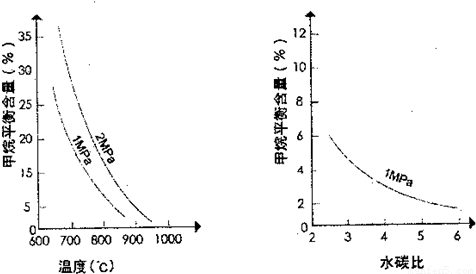
请回答下列问题:
(1)写出该可逆反应的化学方程式:______
(2)根据图判断△H______0,△S______0(选填“>”、“<”或“=”).
(3)假设上述反应在恒容、恒温下进行,判断反应达到平衡状态时的标志是______
A.CO减少的化学反应速率和H2O减少的化学反应速率相等
B.CO、H2O(g)、CH4、H2的浓度都相等
C.CO、H20(g)、CH4、H2的浓度都不再发生变化
D.正、逆反应速率都为零
(4)在图画出压强为2MPa时,CH4平衡含量与水碳比之间关系曲线______.
查看习题详情和答案>>
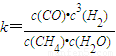 .已知温度、压强和水碳比[
.已知温度、压强和水碳比[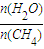 ]对甲烷转化反应的影响如图:
]对甲烷转化反应的影响如图:
请回答下列问题:
(1)写出该可逆反应的化学方程式:______
(2)根据图判断△H______0,△S______0(选填“>”、“<”或“=”).
(3)假设上述反应在恒容、恒温下进行,判断反应达到平衡状态时的标志是______
A.CO减少的化学反应速率和H2O减少的化学反应速率相等
B.CO、H2O(g)、CH4、H2的浓度都相等
C.CO、H20(g)、CH4、H2的浓度都不再发生变化
D.正、逆反应速率都为零
(4)在图画出压强为2MPa时,CH4平衡含量与水碳比之间关系曲线______.
查看习题详情和答案>>