��Ŀ����
��10�֣���Ȼ������Ҫ�ɷ��Ǽ��顣��ijƽ����ϵ�д���CH4��H2O��CO��H2�������壬
��ƽ�ⳣ������ʽΪ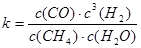 ����֪�¶ȡ�ѹǿ��ˮ̼��[n(H2O)/n(CH4)]�Լ���ת����Ӧ��Ӱ������ͼ��
����֪�¶ȡ�ѹǿ��ˮ̼��[n(H2O)/n(CH4)]�Լ���ת����Ӧ��Ӱ������ͼ��
��ش��������⣺
��1��д���ÿ��淴Ӧ�Ļ�ѧ����ʽ��
��2������ͼ23��1�жϡ�H 0����S 0��ѡ�>������<����=������
��3������������Ӧ�ں��ݡ������½��У��жϷ�Ӧ�ﵽƽ��״̬ʱ�ı�־��
| A��CO���ٵĻ�ѧ��Ӧ���ʺ�H2O�������ٵĻ�ѧ��Ӧ������� |
| B��CO��H2O��g����CH4��H2��Ũ�ȶ���� |
| C��CO��H20��g����CH4��H2��Ũ�ȶ����ٷ����仯 |
| D�������淴Ӧ���ʶ�Ϊ�� |
��10�֣� ��1��CH4(g)+H2O(g) CO(g)+3H2(g)��2�֣�
��1��CH4(g)+H2O(g) CO(g)+3H2(g)��2�֣�
��2��>��2�֣� >��2�֣�
��3��AC��2�֣�
��4����2�֣�˵��ֻҪ2Mpa����1Mpa���Ϸ������֣�
�������㣺����ٷֺ������¶ȡ�ѹǿ�仯���ߣ���ѧƽ��״̬���жϣ�
��������1������ƽ�ⳣ����֪����Ӧ��CO��HΪ�����CH4��H2OΪ��Ӧ���Դ���д��Ӧ�Ļ�ѧ����ʽ��
��2������ƽ���ƶ����ߵı仯�ص��жϷ�Ӧ�ȣ����ݻ��Ҷȵı仯���ж��ر䣻
��3�����ݻ�ѧƽ��Ϊ��̬ƽ�⣬�ﵽƽ��ʱ���淴Ӧ������ȣ������ʵ�Ũ�Ȳ��ٷ����ı����ж�ƽ��״̬��
��4������ѹǿ����ƽ�����淴Ӧ�����ƶ����������ߣ�
��𣺽⣺��1������ƽ�ⳣ����֪����Ӧ��CO��HΪ�����CH4��H2OΪ��Ӧ��
��Ӧ�Ļ�ѧ����ʽΪCH4��g��+H2O��g�� CO��g��+3H2��g����
CO��g��+3H2��g����
�ʴ�Ϊ��CH4��g��+H2O��g�� CO��g��+3H2��g����
CO��g��+3H2��g����
��2������ͼ�������ߵı仯���ƿ�֪�����¶�����ʱ������İٷֺ�����С��˵�������¶�ƽ�����淴Ӧ�����ƶ���������Ӧ���ȣ���H��0����������������ʵ������ڷ�Ӧ����������ʵ��������Ҷ��������S��0��
�ʴ�Ϊ����������
��3��A��CO���ٵĻ�ѧ��Ӧ���ʺ�H2O���ٵĻ�ѧ��Ӧ������ȣ�˵�����淴Ӧ������ȣ��ﵽƽ��״̬����A��ȷ��
B��CO��H2O��g����CH4��H2��Ũ�ȶ���ȣ�����˵���ﵽƽ��״̬��ƽ��ʱ�����ʵ�Ũ��ȡ���ڷ�Ӧʱ�������ʵ�������ͷ�Ӧ�ij̶ȣ���B����
C��CO��H20��g����CH4��H2��Ũ�ȶ����ٷ����仯��˵���ﵽƽ��״̬����C��ȷ��
D�������淴Ӧ���ʶ�Ϊ�㣬����ȷ����ѧƽ��Ϊ��̬ƽ�⣬ƽ��ʱ���淴Ӧ������ȣ���Ϊ0����D����
�ʴ�Ϊ��AC��
��4��ѹǿ����ƽ�����淴Ӧ�����ƶ��������ƽ�⺬����С���ʴ�Ϊ��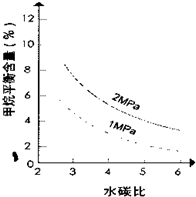
���������⿼�黯ѧƽ���ƶ��Լ�ƽ���ƶ�ͼ�����⣬��Ŀ�ѶȲ�����ע���������ж�ƽ��״̬�ı�־���⣮

�ϳ�������Ҫ�ɷ���һ����̼�������������ںϳɶ����ѵ����ȼ�ϡ�����Ȼ����úϳ��������п��ܷ����ķ�Ӧ�У�
�� CH4(g)��H2O(g)![]() CO(g)��3H2(g) ��H1����206.1 kJ/mol
CO(g)��3H2(g) ��H1����206.1 kJ/mol
�� CH4(g)��CO2(g)![]() 2CO(g)��2H2(g) ��H2����247.3 kJ/mol
2CO(g)��2H2(g) ��H2����247.3 kJ/mol
�� CO(g)��H2O(g)![]() CO2(g)��H2(g) ��H3
CO2(g)��H2(g) ��H3
��ش��������⣺
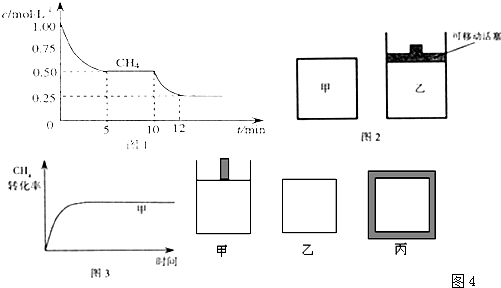
�� ��һ�ܱ������н��з�Ӧ�٣����CH4�����ʵ���Ũ���淴Ӧʱ��ı仯��ͼ1��ʾ����Ӧ���е�ǰ5 min�ڣ� v(H2)�� �� ��10 minʱ���ı��������������� �� ��
|

�� ��ͼ2��ʾ���ڼס����������зֱ��������ʵ�����CH4��CO2��ʹ�ס�����������ʼ�ݻ���ȡ�����ͬ�¶��·�����Ӧ�ڣ���ά�ַ�Ӧ�������¶Ȳ��䡣��֪��������CH4��ת������ʱ��仯��ͼ����ͼ3��ʾ������ͼ3�л�����������CH4��ת������ʱ��仯��ͼ��

�� ��Ӧ���Ц�H3�� �� ��800��ʱ����Ӧ�۵Ļ�ѧƽ�ⳣ��K��1.0��ijʱ�̲�ø��¶��µ��ܱ������и����ʵ����ʵ������±���
| CO | H2O | CO2 | H2 |
| 0.5 mol | 8.5 mol | 2.0 mol | 2.0 mol |
��ʱ��Ӧ���������淴Ӧ���ʵĹ�ϵʽ�� �� ������ţ���
a��v(��)��v(��) b��v(��)��v(��) c��v(��)��v(��) d�����ж�



 ��Ȼ������Ҫ�ɷּ���ȼ�����ɶ�����̼��Һ̬ˮ���Ȼ�ѧ����ʽ���£���ش��������⣺CH4��g��+2O2��g��=CO2��g��+2H2O��l����H=-889.6kJ/mol��
��Ȼ������Ҫ�ɷּ���ȼ�����ɶ�����̼��Һ̬ˮ���Ȼ�ѧ����ʽ���£���ش��������⣺CH4��g��+2O2��g��=CO2��g��+2H2O��l����H=-889.6kJ/mol��