网址:http://m.1010jiajiao.com/timu3_id_351066[举报]
实验一:甲同学利用Al、Fe、Mg和2 mol·L-1的稀硫酸,设计实验方案研究影响反应速率的因素。
研究的实验报告如下表:
实验步骤 | 现象 | 结论 |
①分别取等体积的2 mol·L-1硫酸于试管中;②分别投入大小、形状相同的Al、Fe、Mg | 反应快慢:Mg>Al>Fe | 反应物的性质越活泼,反应速率越快 |
(1)该同学的实验目的是________________________;要得出正确的实验结论,还需控制的实验条件是________________________。
(2)乙同学为了更精确地研究浓度对反应速率的影响,利用下图装置同温下进行定量实验。用大小形状相同的Fe分别和0.5 mol·L-1及2 mol·L-1的足量稀硫酸反应。通过______________可以说明浓度对化学反应速率的影响。

实验二:已知2KMnO4+5H![]() K2SO4+2MnSO4+8H2O+10CO2↑,在开始一段时间内,反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快。
K2SO4+2MnSO4+8H2O+10CO2↑,在开始一段时间内,反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快。
(1)针对上述现象,某同学认为该反应放热,导致溶液温度上升,反应速率加快。从影响化学反应速率的因素看,你猜想还可能是________________的影响。
(2)若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液试剂外,可以在反应一开始时加入____________。
A.硫酸钾 B.硫酸锰 C.氯化锰 D.水
查看习题详情和答案>>Ⅰ、影响化学反应速率的因素很多,某课外兴趣小组用实验的方法通过图1所示装置研究反应速率的有关问题.

(1)现设计如下实验方案探究温度和c(H2SO4)对锌与稀硫酸反应速率的影响.
①请在表格空白处填写适当的反应条件.
| 编号 | 实验目的 | 锌粒 | 温度 | c(H2SO4) | 需测量的数据 |
| Ⅰ | 为以下实验作参照 | 3粒 | 25℃ | c1 | a |
| Ⅱ | 探究温度对反应速率的影响 | 3粒 | 50℃ | c1 c1 |
b |
| Ⅲ | 探究浓度对反应速率的影响 | 3粒 | 25℃ 25℃ |
c2 | d |
②“需测量的数据”是
(2)对于实验Ⅰ,锌粒与H2SO4反应生成H2的量与反应时间的关系曲线如图2所示.请在图3中画出上述反应的速率(mL/min)与时间(min)的关系曲线图.
Ⅱ、在一定温度下,有a.盐酸 b.硫酸 c.醋酸三种酸.在不同情况下可能有以下关系:
A.b>a>c B.b>a=c C.c>a>b D.c>a=b E.a=b>c
请从上述选项中选择合适的答案.
(3)当三种酸溶液pH相同时,三者物质的量浓度关系顺序是
(4)同体积、同物质的量浓度的三种酸,中和NaOH的能力由大到小的顺序是
(5)当三者c(H+)相同、体积相同时,同时加入形状、密度、质量完全相同的锌,若产生相同体积的H2(相同状况),反应所需时间的长短关系是
(6)将pH相同的三种酸均加水稀释至原来的100倍后,c(H+)由大到小的顺序是
(12分)(一)、下列各项分别与哪个影响化学反应速率的因素的关系最为密切?
(1)硫在氧气中比在空气中燃烧剧烈
(2)MnO2加入双氧水中反应更剧烈
(3)同质量的铁片和铁粉与足量的同浓度的盐酸反应,后者先反应完
(4)镁粉在冷水中反应仅有微量气泡逸出,但加热时则有大量气泡产生
(二)、氮化硅是一种新型陶瓷材料,它可由石英晶体与焦炭颗粒在高温的氮气流中,通过如下反应制得:3SiO2 + 6C + 2N2 Si3N4 + 6CO,该反应过程中的能量变化如图所示;回答下列问题:
Si3N4 + 6CO,该反应过程中的能量变化如图所示;回答下列问题:
(1)上述反应中的还原剂是 ,还原产物是 。
(2)若反应中测得生成4.48 L CO气体(标准状况下),则转移的电子数为 。
(3)该反应是 (填“吸热”或“放热”)反应。
(三)、在一定温度下,4L密闭容器内某一反应中气体M、气体N的物质的量随时间变化的曲线如图所示: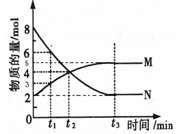
(1)写出该反应的化学方程式为 。
(2)比较t2时刻,正逆反应速率大小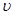 (正)
(正) 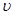 (逆)。(填“>”、“=”、“<”)。.
(逆)。(填“>”、“=”、“<”)。.
(3)若t2=2min,计算反应开始至t2时刻,M的平均化学反应速率为 。
(4)t3时刻化学反应达到平衡时反应物的转化率为 。
(1)硫在氧气中比在空气中燃烧剧烈
(2)MnO2加入双氧水中反应更剧烈
(3)同质量的铁片和铁粉与足量的同浓度的盐酸反应,后者先反应完
(4)镁粉在冷水中反应仅有微量气泡逸出,但加热时则有大量气泡产生
(二)、氮化硅是一种新型陶瓷材料,它可由石英晶体与焦炭颗粒在高温的氮气流中,通过如下反应制得:3SiO2 + 6C + 2N2
 Si3N4 + 6CO,该反应过程中的能量变化如图所示;回答下列问题:
Si3N4 + 6CO,该反应过程中的能量变化如图所示;回答下列问题: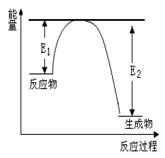
(1)上述反应中的还原剂是 ,还原产物是 。
(2)若反应中测得生成4.48 L CO气体(标准状况下),则转移的电子数为 。
(3)该反应是 (填“吸热”或“放热”)反应。
(三)、在一定温度下,4L密闭容器内某一反应中气体M、气体N的物质的量随时间变化的曲线如图所示:
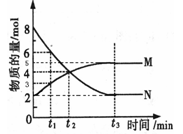
(1)写出该反应的化学方程式为 。
(2)比较t2时刻,正逆反应速率大小
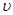 (正)
(正) 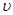 (逆)。(填“>”、“=”、“<”)。.
(逆)。(填“>”、“=”、“<”)。.(3)若t2=2min,计算反应开始至t2时刻,M的平均化学反应速率为 。
(4)t3时刻化学反应达到平衡时反应物的转化率为 。
(6分)、右图是研究外界因素对过氧化氢分解反应速率影响的实验装置图。某学生研究小组在50mL量筒中盛满水,倒置于水槽中,通过分液漏斗把过氧化氢溶液加入锥形瓶中(内中已有适量二氧化锰催化剂),记录各时间段在室温下收集到的氧气的体积。
第1组:粉末状的二氧化锰0.2g+ 5ml 6% H2O2
第2组:粉末状的二氧化锰0.2g+ 3ml 12% H2O2
第3组:粉末状的二氧化锰0.1g+ 5ml 6% H2O2[来源:ZXXK]
第4组:颗粒状的二氧化锰0.1g+ 5ml 6% H2O2
| 催化剂:MnO2 | 第1组 | 第2组 | 第3组 | 第4组 |
| 前15s产生氧气的量(ml) | 11 | 15 | 8 | 7 |
| 前30s产生氧气的量(ml) | 21 | 24 | 11 | 9 |
| 前45s产生氧气的量(ml) | 31 | 35 | 18 | 12 |
| 前60s产生氧气的量(ml) | 45 | 48 | 26 | 15 |
(1)写出H2O2分解的反应方程式: ;
(2)从实验的几组数据中能得到的是: ;
(3)实验比较反应速率时可以测定相同时间内产生气体的体积,也可测 。
查看习题详情和答案>>