摘要:9.NCl3的电子式为.则NCl3与H2O反应时.最初的生成物一定有 A.NH3 B.HNO2 C.HClO D.NH4Cl 10.青霉素试验针用它的稀溶液.现有1小瓶20万国际单位青霉素.1.0mL注射器.注射用水和几个干净小瓶.现吸取1.0mL注射用水注入第1瓶内溶解青霉素.吸取0.1 mL溶液在第2 小瓶中用水稀释成1.0mL.再吸取0.1mL在第3小瓶中稀释成1.0mL.又--在第几小瓶中青霉素浓度为200国际单位/mL. A.3 B.4 C.5 D.6
网址:http://m.1010jiajiao.com/timu3_id_350999[举报]
在密闭容器中,将1.0mol CO与1.0mol H2O混合加热到800℃,发生下列反应:CO(g)+H2O(g)?CO2(g)+H2(g),一段时间后该反应达到平衡,测得CO的物质的量为0.5mol.回答下列问题:
①平衡时CO的转化率为
②如果继续向该平衡体系中通入1.0mol的H2O(g),相同条件下反应达到新的平衡状态,则CO的转化率将
③427℃时该反应的平衡常数为9.4,请结合①中的计算结果判断该反应的△H
④若800K时,起始浓度c(CO)=a mol/L,c(H2O)=b mol/L,H2的平衡浓度c(H2)=c mol/L,a、b、c之间的关系式是
查看习题详情和答案>>
①平衡时CO的转化率为
50%
50%
,该反应的化学平衡常数为1
1
.(写出计算过程)②如果继续向该平衡体系中通入1.0mol的H2O(g),相同条件下反应达到新的平衡状态,则CO的转化率将
增大
增大
(填“增大”、“减小”、“不变”),计算CO的转化率为66.7%
66.7%
.③427℃时该反应的平衡常数为9.4,请结合①中的计算结果判断该反应的△H
<
<
0(填“>”、“═”、“<”).④若800K时,起始浓度c(CO)=a mol/L,c(H2O)=b mol/L,H2的平衡浓度c(H2)=c mol/L,a、b、c之间的关系式是
ac+bc=ab
ac+bc=ab
;当a=b时,a=2
2
c.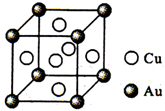 催化剂中毒是微量杂质和催化剂活性中心的某种化学成分作用,形成没有活性的物质.CO会使合成氨的催化剂(还原铁)中毒,CO易与Fe发生反应Fe+5CO═Fe(CO)5.除去CO的化学反应方程式(HAc表示醋酸):Cu(NH3)2Ac+CO+NH3═Cu(NH3)3(CO)Ac.
催化剂中毒是微量杂质和催化剂活性中心的某种化学成分作用,形成没有活性的物质.CO会使合成氨的催化剂(还原铁)中毒,CO易与Fe发生反应Fe+5CO═Fe(CO)5.除去CO的化学反应方程式(HAc表示醋酸):Cu(NH3)2Ac+CO+NH3═Cu(NH3)3(CO)Ac.请回答下列问题:
(1)C、N、O的第一电离能由小到大的顺序为
C<O<N
C<O<N
.(2)写出基态Fe的核外电子排布式
ls22s22p63s23p63d64s2
ls22s22p63s23p63d64s2
.(3)配合物Cu(NH3)3(CO)Ac中含有的化学键是
BCDF
BCDF
.A.金属键 B.离子键 C.非极性键 D.配位键 E.氢键 F.极性键
(4)等电子体指价电子数和原子数(氢等轻原子不计在内)相同的分子、离子或基团.写出与CO互为等电子体的离子
CN-
CN-
(任写一个).(5)在一定条件下NH3与CO能合成化肥尿素[CO(NH2)2],尿素中C原子轨道的杂化类型为
sp2
sp2
.(6)铜金合金形成的晶胞如图所示.其中Cu、Au原子个数比为
3:l
3:l
,预测其熔点比铜的低
低
(填“高”“相等”或“低”).常温下,如果取0.2mol/LCH3COOH溶液与0.2mol/L NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的PH=9,试回答以下问题:
(1)写出该混合过程中所发生反应的离子方程式:
(2)混合溶液中由水电离出的c(H+)和PH=9的NaOH溶液中由水电离出c(H+)的比值为
(3)求混合溶液中下列算式的计算结果:
c(Na+)-c(CH3COO-)=
c(OH-)-c(CH3COOH)=
(4)若HCl溶液与NaOH溶液反应的中和热数值为53.7kJ/mol,则1molCH3COOH与1mol NaOH在溶液中反应所放出的热与57.3kJ/mol相比会
(5)将同温度下等浓度的下列四种盐溶液:
A.NH4HCO3 B.NH4Cl C.(NH4)2SO4 D.CH3COONH4
按PH由大到小的顺序排列:
查看习题详情和答案>>
(1)写出该混合过程中所发生反应的离子方程式:
HAc+OH-=Ac-+H2O
HAc+OH-=Ac-+H2O
,混合溶液的PH=9的原因是:(用必要的文字和离子方程式表示)Ac-离子水解显碱性,离子反应为Ac-+H2O?HAc+OH-
Ac-离子水解显碱性,离子反应为Ac-+H2O?HAc+OH-
.(2)混合溶液中由水电离出的c(H+)和PH=9的NaOH溶液中由水电离出c(H+)的比值为
104:1
104:1
.(3)求混合溶液中下列算式的计算结果:
c(Na+)-c(CH3COO-)=
10-5-10-9
10-5-10-9
mol/L(列出算式即可)c(OH-)-c(CH3COOH)=
10-9
10-9
moL/L(写出精确结果.)(4)若HCl溶液与NaOH溶液反应的中和热数值为53.7kJ/mol,则1molCH3COOH与1mol NaOH在溶液中反应所放出的热与57.3kJ/mol相比会
偏小
偏小
(“相等”或“偏大”、“偏小”.)(5)将同温度下等浓度的下列四种盐溶液:
A.NH4HCO3 B.NH4Cl C.(NH4)2SO4 D.CH3COONH4
按PH由大到小的顺序排列:
ADBC
ADBC
(填字母序号.)(9分)叠氮化合物应用广泛,如NaN3可用于汽车安全气囊,PhCH2N3可用于合成化合物V(见下图,仅列出部分反应条件,Ph—代表苯基  )。
)。
(1)下列说法不正确的是________(填字母)。
A.反应①、④属于取代反应
B.化合物Ⅰ可生成酯,但不能发生氧化反应
C.一定条件下化合物Ⅱ能生成化合物Ⅰ
D.一定条件下化合物Ⅱ能与氢气反应,反应类型与反应②相同
(2)化合物Ⅱ发生聚合反应的化学方程式为________(不要求写出反应条件)。
(3)反应③的化学方程式为______________________(要求写出反应条件)。
(4)化合物Ⅲ与PhCH2N3发生环加成反应生成化合物V,不同条件下环加成反应还可生成化合物V的同分异构体 。该同分异构体的分子式为________,结构式为_
。该同分异构体的分子式为________,结构式为_ _________________。
_________________。
(5)科学家曾预言可合成C(N3)4,其可分解成单质,用作炸药。有人通过NaN3与NC—CCl3反应成功合成了该物质。下列说法正确的是________(填字母)。
A.该合成反应可能是取代反应
B.C(N3)4与甲烷具有类似的空间结构
C.C(N3)4不可能与化合物Ⅲ发生环加成反应
D.C(N3)4分解爆炸的化学反应方程式可能为:C(N3)4―→C+6N2↑