网址:http://m.1010jiajiao.com/timu3_id_350918[举报]
《物质结构与性质》模块选择题
1.下列性质不能用金属键理论解释的是
A.导电性 B.导热性 C.延展性 D.锈蚀性
2.下列说法错误的是
A.O3与SO2的结构与性质相似
B.硫粉不溶于水,易溶于CS2中
C.Be(OH)2是两性氢氧化物
D.在相同条件下, 的沸点高于
的沸点高于![]()
3.氨气溶于水时,大部分NH3与H2O以氢键(用“…”表示)结合形成NH3·H2O分子,根据氨水的性质可推知NH3·H2O的结构式为
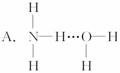

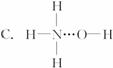

《有机化学基础》模块选择题
4.已知某有机物A的分子式C2H6O的红外光谱和核磁共振氢谱如下图所示,下列说法中错误的是
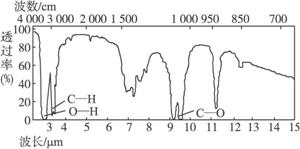
未知物A的红外光谱
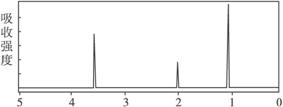
未知物A的核磁共振氢谱
A.由红外光谱可知,该有机物中至少含有三种不同的化学键
B.由核磁共振氢谱可知,该有机物分子中有三种不同的氢原子且个数比为1∶2∶3
C.仅由其核磁共振氢谱可知其分子中的各类型氢原子总数
D.则A的结构简式为CH3—O—CH3
5.在阿司匹林的结构简式(下式)中①②③④⑤⑥分别标出了其分子中的不同的键。将阿司匹林与足量NaOH溶液共煮时,发生反应时断键的位置是
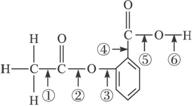
A.①④ B.②⑤ C.③④ D.②⑥
6.举办“人文奥运”的一个重要体现就是禁止运动员服用兴奋剂。有一种兴奋剂的结构简式如下式,下列有关该物质的说法正确的是
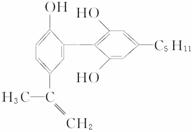
A.该分子中所有碳原子可以稳定地共存在一个平面中
B.1 mol该物质与浓溴水和H2反应时,最多消耗Br2和H2的物质的量分别为4 mol、7 mol
C.遇FeCl3溶液显紫色,因为该物质与苯酚属于同系物
D.滴入酸性KMnO4溶液,观察到紫色褪去,可证明分子中存在双键
查看习题详情和答案>>下列曲线分别表示元素的某种性质与核电荷数的关系(Z为核电荷数,Y为元素的有关性质).则下列有关Y的意义的叙述正确的是

A.a图表示第三周期元素的原子半径(稀有气体除外)
B.b图表示ⅡA族元素的最外层电子数
C.c图表示第二周期元素的电负性(稀有气体除外)
D.d图表示第三周期元素的第一电离能(稀有气体除外)
E.e图表示第ⅦA族元素氢化物的沸点
(II)
波尔多液是一种保护性杀菌剂,广泛应用于树木、果树和花卉上,鲜蓝色的胆矾晶体是配制波尔多液的主要原料.胆矾CuSO4?5H2O可写成[Cu(H2O)4]SO4?H2O,其结构示意图如下:

(1)写出铜原子价层电子的轨道排布式


(2)由上图可知:胆矾中存在的作用力有
a.离子键 b.配位键 c.氢键 d.极性键 e.非极性键
(3)往浓CuSO4溶液中加入过量较浓的NH3?H2O直到原先生成的沉淀恰好溶解为止,得到深蓝色溶液.小心加入约和溶液等体积的C2H5OH并使之分成两层,静置.经过一段时间后可观察到在两层“交界处”下部析出深蓝色Cu(NH3)4SO4?H2O晶体.实验中所加C2H5OH的作用是
(4)已知Cu(NH3)42+呈平面正方形结构,则Cu(NH3)4SO4?H2O晶体中呈正四面体的粒子是
(5)如将深蓝色溶液加热,可能得到什么结果?
《物质结构与性质》
19-1.(6分,该题为多项选择题,全选对得6分,漏选按比例给分,错选或多选为0分)下列说法正确的是 ( )
| A.基态原子中不一定都有未成对的电子 |
| B.由极性键形成的分子一定是极性分子 |
| C.晶格能大小顺序:NaCl > KCl |
| D.离子晶体中每个阳离子周围均吸引着6个带相反电荷的离子 |
19-2.(14分)四种常见元素的性质或结构信息如下表,试根据信息回答有关问题。
| 元素 | A | B | C | D |
| 性质 结构 信息 | 基态原子核外有两个电子层,最外层有3个未成对的电子 | 基态原子的M层有1对成对的p电子 | 基态原子核外电子排布为[Ar]3d104sx,有+1、+2两种常见化合价 | 有两种常见氧化物,其中有一种是冶金工业常用的还原剂 |
(2)A元素的氢化物的沸点比同主族相邻元素氢化物沸点 (填“高”或“低”),其原因是 。
(3)D元素最高价氧化物的熔点比同主族相邻元素最高价氧化物的熔点 (填“高”或“低”),其原因是 。
(4)往C元素的硫酸盐溶液中逐滴加入过量A元素的氢化物水溶液,可生成的配合物的化学式为 ,简要描述该配合物中化学键的成键情况 。
(5)下列分子结构图中的“●”表示上述相关元素的原子中除去最外层电子的剩余部分,“ O”表示氢原子,小黑点“ ·”表示没有形成共价键的最外层电子,短线表示共价键。

则在以上分子中,中心原子采用sp3杂化形成化学键的是 (填写序号);在②的分子中有 个σ键和 个π键。 查看习题详情和答案>>
(20分)
(I)多项选择题(6分)
CH3+、CH3-、CH3-都是重要的有机反应中间体,有关它们的说法正确的是 。
A.它们均由甲烷去掉一个氢原子所得
B.它们互为等电子体,碳原子均采取sp2杂化
C.CH3-与NH3、H3O+互为等电子体,几何构型均为三角锥形
D.CH3+中的碳原子采取sp2杂化,所有原子均共面
E.两个CH3-或一个CH3+和CH3-结合均可得到CH3CH3
(II)(14分)
锌是一种重要的金属,锌及其化合物有着广泛的应用。
(1)指出锌在周期表中的位置: 周期, 族, 区。
(2)葡萄糖酸锌[CH2OH(CHOH)4COO]2Zn是目前市场上流行的补锌剂。写出Zn2+基态电子排布式 ;葡萄糖分子中碳原子杂化方式有 。
(3)Zn2+能与NH3形成配离子[Zn(NH3)4]2+。配位体NH3分子属于 (填“极性分子”或“非极性分子”);在[Zn(NH3)4]2+中,Zn2+位于正四面体中心,N位于正四面体的顶点,试在左下图中表示[Zn(NH3)4]2+中Zn2+与N之间的化学键。


(4)右上图表示锌与某非金属元素X形成的化合物晶胞,其中Zn和X通过共价键结合,该化合物的化学式为 ;该化合物的晶体熔点比干冰高得多,原因是 。
查看习题详情和答案>>
(20分)
(I)多项选择题(6分)
关于化工生产的下列叙述中,正确的是 。
A.生产普通玻璃的原料是石灰石、石英、纯碱,在玻璃熔炉中发生复杂的物理化学变化
B.工业上合成氨没有采用更大的压强是从设备和动力要求方面考虑的
C.加热法只适用于软化暂时硬度的硬水
D.工业上采用电解熔融氯化铝生产金属铝
E.用高纯度焦炭与石英砂反应可制得纯度达到9个9的单晶硅材料
(II)(14分)
工业上制取硝酸铵的流程图如下,请回答下列问题:?

(1)1909年化学家哈伯在实验室首次合成了氨。2007年化学家格哈德·埃特尔在哈伯研究所证实了氢气与氮气在固体催化剂表面合成氨的反应过程,示意如下:

 分别表示N2、H2、NH3。图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是
、
。
分别表示N2、H2、NH3。图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是
、
。
(2)在合成氨的设备(合成塔)中,设置热交换器的目的是 ;
在合成硝酸的吸收塔中通入空气的目的是 。
(3)生产硝酸的过程中常会产生一些氮的氧化物,可用如下两种方法处理:
碱液吸收法:NO+NO2+2NaOH===2NaNO2+H2O
NH3还原法:8NH3+6NO2 7N2+12H2O(NO也有类似的反应)
7N2+12H2O(NO也有类似的反应)
请从绿色化学的角度分析两种方法的优劣:
(4)某化肥厂用NH3制备NH4NO3。已知:由NH3制NO的产率是96%、NO制HNO3的产率是92%,则制HNO3所用去的NH3的质量占总耗NH3质量(不考虑其它损耗)的 %。
(5)硝酸铵是一种常用的氮肥,在贮存和使用该化肥时,把应注意的事项及理由填入下表。
|
|
注意事项 |
理由 |
|
① |
|
|
|
② |
|
|
查看习题详情和答案>>