网址:http://m.1010jiajiao.com/timu3_id_350842[举报]
物质结构与性质:
Mn、Fe均为第四周期过渡元素,两元素的部分电离能数据列于下表:

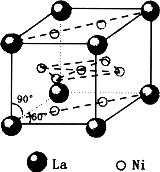
回答下列问题:
(1)Mn元素价电子层的电子排布式为________,比较两元素的l2、l3可知,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难.对此,你的解释是________;
(2)Fe原子或离子外围有较多能量相近的空轨道而能与一些分子或离子形成配合物.
①与Fe原子或离子形成配合物的分子或离子应具备的结构特征是________;
②六氰合亚铁离子(Fe(CN)64-)中的配体CN-中C原子的杂化轨道类型是________,写出一种与CN-互为等电子体的单质分子的路易斯结构式_________;
(3)三氯化铁常温下为固体,熔点282℃,沸点315℃,在300℃以上易升华.易溶于水,也易溶于乙醚、丙酮等有机溶剂.据此判断三氯化铁晶体为________;
(4)金属铁的晶体在不同温度下有两种堆积方式,晶胞分别如图所示.面心立方晶胞和体心立方晶胞中实际含有的Fe原子个数之比为________.

A、B、C、D、E都是短周期主族元素,原子序数依次增大,B、C同周期,A、D同主族,E的单质既可溶于稀硫酸又可溶于氢氧化钠溶液.a、b能形成两种在常温下呈液态的化合物甲和乙,原子个数比分别为2:1和1:1.根据以上信息回答下列1-3问:
(1)C和D的离子中,半径较小的是______ (填离子符号).
(2)实验室在测定C的气态氢化物的相对分子质量时,发现实际测定值比理论值大出许多,其原因是______.
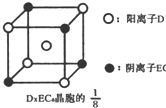
(3)C、D、E可组成离子化合物DxE6其晶胞(晶胞是在晶体中具有代表性的最小重复单元)结构如图所示,阳离子D+(用0表示)位于正方体的棱的中点和正方体内部;阴离子EC6x-(用

示)位于该正方体的顶点和面心,该化合物的化学式是______.
(4)Mn、Fe均为第四周期过渡元素,两元素的部分电离能数据列于下表:
| 元素 | Mn | Fe | |
| 电离 能/kj?mol-1[来源:] |
Ⅰ1 | 717 | 759 |
| Ⅱ2 | 1509 | 1561 | |
| Ⅲ3 | 3248 | 2957 |
Mn元素价电子层的电子排布式为______,比较两元素的I2J3可知,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难.对此的解释是______;
(5)Fe原子或离子外围有较多能量相近的空轨道而能与一些分子或离子形成配合物.
①与Fe原子或离子形成配合物的分子或离子应具备的结构特征是______.
②六氰合亚铁离子(Fe(CN)64-)中的配体CN-中c原子的杂化轨遣类型是______;
写出一种与CN-互为等电子体的单质分子的路易斯结构式______.
A、B、C、D、E都是短周期主族元素,原子序数依次增大,B、C同周期,A、D同主族,E的单质既可溶于稀硫酸又可溶于氢氧化钠溶液.a、b能形成两种在常温下呈液态的化合物甲和乙,原子个数比分别为2:1和1:1.根据以上信息回答下列1-3问:
(1)C和D的离子中,半径较小的是______ (填离子符号).
(2)实验室在测定C的气态氢化物的相对分子质量时,发现实际测定值比理论值大出许多,其原因是______.
(3)C、D、E可组成离子化合物DxE6其晶胞(晶胞是在晶体中具有代表性的最小重复单元)结构如图所示,阳离子D+(用0表示)位于正方体的棱的中点和正方体内部;阴离子EC6x-(用
 示)位于该正方体的顶点和面心,该化合物的化学式是______.
示)位于该正方体的顶点和面心,该化合物的化学式是______.
(4)Mn、Fe均为第四周期过渡元素,两元素的部分电离能数据列于下表:
| 元素 | Mn | Fe | |
| 电离 能/kj?mol-1[来源:] | Ⅰ1 | 717 | 759 |
| Ⅱ2 | 1509 | 1561 | |
| Ⅲ3 | 3248 | 2957 |
Mn元素价电子层的电子排布式为______,比较两元素的I2J3可知,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难.对此的解释是______;
(5)Fe原子或离子外围有较多能量相近的空轨道而能与一些分子或离子形成配合物.
①与Fe原子或离子形成配合物的分子或离子应具备的结构特征是______.
②六氰合亚铁离子(Fe(CN)64-)中的配体CN-中c原子的杂化轨遣类型是______;
写出一种与CN-互为等电子体的单质分子的路易斯结构式______.
查看习题详情和答案>>
〔化学—选修3:物质结构与性质〕(15分)
早期发现的一种天然准晶颗粒由三种Al、Cu、Fe元素组成。回答下列问题:
(1)准晶是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过 方法区分晶体、准晶体和非晶体。
(2)基态铁原子有 个未成对电子,三价铁离子的电子排布式为: 可用硫氰化钾奉验三价铁离子,形成配合物的颜色为
(3)新制备的氢氧化铜可将乙醛氧化为乙酸,而自身还原成氧化亚铜,乙醛中碳原子的杂化轨道类型为 ;一摩尔乙醛分子中含有的σ键的数目为: 。乙酸的沸点明显高于乙醛,其主要原因是: 。氧化亚铜为半导体材料,在其立方晶胞内部有四个氧原子,其余氧原子位于面心和顶点,则该晶胞中有 个铜原子。
(4)铝单质为面心立方晶体,其晶胞参数a=0.405nm,晶胞中铝原子的配位数为 。列式表示铝单质的密度 g·cm-3(不必计算出结果)
早期发现的一种天然准晶颗粒由三种Al、Cu、Fe元素组成。回答下列问题:
(1)准晶是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过 方法区分晶体、准晶体和非晶体。
(2)基态铁原子有 个未成对电子,三价铁离子的电子排布式为: 可用硫氰化钾奉验三价铁离子,形成配合物的颜色为
(3)新制备的氢氧化铜可将乙醛氧化为乙酸,而自身还原成氧化亚铜,乙醛中碳原子的杂化轨道类型为 ;一摩尔乙醛分子中含有的σ键的数目为: 。乙酸的沸点明显高于乙醛,其主要原因是: 。氧化亚铜为半导体材料,在其立方晶胞内部有四个氧原子,其余氧原子位于面心和顶点,则该晶胞中有 个铜原子。
(4)铝单质为面心立方晶体,其晶胞参数a=0.405nm,晶胞中铝原子的配位数为 。列式表示铝单质的密度 g·cm-3(不必计算出结果)