题目内容
[化学一选修物质结构与性质]A、B、C、D、E都是短周期主族元素,原子序数依次增大,B、C同周期,A、D同主族,E的单质既可溶于稀硫酸又可溶于氢氧化钠溶液.a、b能形成两种在常温下呈液态的化合物甲和乙,原子个数比分别为2:1和1:1.根据以上信息回答下列1-3问:
(1)C和D的离子中,半径较小的是______ (填离子符号).
(2)实验室在测定C的气态氢化物的相对分子质量时,发现实际测定值比理论值大出许多,其原因是______.
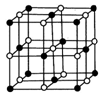
(3)C、D、E可组成离子化合物DxE6其晶胞(晶胞是在晶体中具有代表性的最小重复单元)结构如图所示,阳离子D+(用0表示)位于正方体的棱的中点和正方体内部;阴离子EC6x-(用
 示)位于该正方体的顶点和面心,该化合物的化学式是______.
示)位于该正方体的顶点和面心,该化合物的化学式是______.
(4)Mn、Fe均为第四周期过渡元素,两元素的部分电离能数据列于下表:
| 元素 | Mn | Fe | |
| 电离 能/kj?mol-1[来源:] | Ⅰ1 | 717 | 759 |
| Ⅱ2 | 1509 | 1561 | |
| Ⅲ3 | 3248 | 2957 |
Mn元素价电子层的电子排布式为______,比较两元素的I2J3可知,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难.对此的解释是______;
(5)Fe原子或离子外围有较多能量相近的空轨道而能与一些分子或离子形成配合物.
①与Fe原子或离子形成配合物的分子或离子应具备的结构特征是______.
②六氰合亚铁离子(Fe(CN)64-)中的配体CN-中c原子的杂化轨遣类型是______;
写出一种与CN-互为等电子体的单质分子的路易斯结构式______.
【答案】分析:A、B、C、D、E都是短周期主族元素,原子序数依次增大,E的单质既可溶于稀硫酸又可溶于氢氧化钠溶液,则E为铝元素;A、B能形成两种在常温下呈液态的化合物甲和乙,原子个数比分别为2:1和1:1,甲为H2O2,乙为H2O,则A为氢元素,B为氧元素.A、D同主族,D原子序数大于氧元素小于铝元素,故D为钠元素;B、C同周期,C原子序数大于氧元素,故C为氟元素.
(1)电子层结构相同,核电荷数越大,离子半径越小.
(2)HF中含有氢键相结合的聚合氟化氢分子(HF)n.
(3)根据均摊法计算.
(4)Mn元素为25号元素,根据核外电子排布规律书写,价电子层的电子排布式.
由Mn2+转化为Mn3+时,3d能级由较稳定的3d5半充满状态转为不稳定的3d4状态;而Fe2+到Fe3+时,3d能级由不稳定的3d6到稳定的3d5半充满状态.
(5)①形成配位键具备中心离子具有能量相近的空轨道,配体具有弧对电子.
②配体CN-中C原子有1对孤对电子对,碳原子与氮原子之间形成C≡N,杂化轨道数为2.与CN-互为等电子体的单质分子有N2等,氮气中氮原子之间形成3对共用电子对.
解答:解:A、B、C、D、E都是短周期主族元素,原子序数依次增大,E的单质既可溶于稀硫酸又可溶于氢氧化钠溶液,则E为铝元素;A、B能形成两种在常温下呈液态的化合物甲和乙,原子个数比分别为2:1和1:1,甲为H2O2,乙为H2O,则A为氢元素,B为氧元素.A、D同主族,D原子序数大于氧元素小于铝元素,故D为钠元素;B、C同周期,C原子序数大于氧元素,故C为氟元素.
故A为氢元素,B为氧元素,C为氟元素、D为钠元素,E为铝元素;
(1)C为氟元素、D为钠元素,F-与Na+电子层结构相同,核电荷数越大,离子半径越小,所以离子半径F->Na+,半径较小的是Na+.
故答案为:Na+.
(2)C为氟元素,C的气态氢化物为HF,由于HF中含有氢键相结合的聚合氟化氢分子(HF)n,反应实验室在测定C的气态氢化物的相对分子质量时,发现实际测定值比理论值大出许多.
故答案为:由于HF中含有氢键相结合的聚合氟化氢分子(HF)n.
(3)C为氟元素、D为钠元素,E为铝元素,由晶胞结构可知 晶胞中,Na+数目为1+4×
晶胞中,Na+数目为1+4× =1.5,阴离子AlF6x-为4×
=1.5,阴离子AlF6x-为4× =0.5,根据电荷守恒可知,1.5=0.5x,所以x=3,所以化学式为Na3AlF6.
=0.5,根据电荷守恒可知,1.5=0.5x,所以x=3,所以化学式为Na3AlF6.
故答案为:Na3AlF6.
(4)Mn元素为25号元素,核外电子排布式为[Ar]3d54s2,所以价层电子排布式为3d54s2;由Mn2+转化为Mn3+时,3d能级由较稳定的3d5半充满状态转为不稳定的3d4状态需要的能量较多;而Fe2+到Fe3+时,3d能级由不稳定的3d6到稳定的3d5半充满状态,需要的能量相对要少.
故答案为:3d54s2;由Mn2+转化为Mn3+时,3d能级由较稳定的3d5半充满状态转为不稳定的3d4状态需要的能量较多;而Fe2+到Fe3+时,3d能级由不稳定的3d6到稳定的3d5半充满状态,需要的能量相对要少.
(5)Fe原子或离子外围有较多能量相近的空轨道而能与一些分子或离子形成配合物.
①与Fe原子或离子形成配合物的分子或离子应具有弧对电子.
故答案为:具有弧对电子.
②六氰合亚铁离子(Fe(CN)64-)中的配体CN-中C原子有1对孤对电子对,碳原子与氮原子之间形成C≡N,杂化轨道数为2,碳原子的杂化为sp.与CN-互为等电子体的单质分子有N2等,路易斯结构式 N≡N.
故答案为:sp;N≡N.
点评:题目综合性较大,涉及结构性质与位置关系、元素周期律、晶体结构、化学键等,难度较大,是对所学知识的综合考查与学生能力的考查,注意基础知识的全面掌握.
(1)电子层结构相同,核电荷数越大,离子半径越小.
(2)HF中含有氢键相结合的聚合氟化氢分子(HF)n.
(3)根据均摊法计算.
(4)Mn元素为25号元素,根据核外电子排布规律书写,价电子层的电子排布式.
由Mn2+转化为Mn3+时,3d能级由较稳定的3d5半充满状态转为不稳定的3d4状态;而Fe2+到Fe3+时,3d能级由不稳定的3d6到稳定的3d5半充满状态.
(5)①形成配位键具备中心离子具有能量相近的空轨道,配体具有弧对电子.
②配体CN-中C原子有1对孤对电子对,碳原子与氮原子之间形成C≡N,杂化轨道数为2.与CN-互为等电子体的单质分子有N2等,氮气中氮原子之间形成3对共用电子对.
解答:解:A、B、C、D、E都是短周期主族元素,原子序数依次增大,E的单质既可溶于稀硫酸又可溶于氢氧化钠溶液,则E为铝元素;A、B能形成两种在常温下呈液态的化合物甲和乙,原子个数比分别为2:1和1:1,甲为H2O2,乙为H2O,则A为氢元素,B为氧元素.A、D同主族,D原子序数大于氧元素小于铝元素,故D为钠元素;B、C同周期,C原子序数大于氧元素,故C为氟元素.
故A为氢元素,B为氧元素,C为氟元素、D为钠元素,E为铝元素;
(1)C为氟元素、D为钠元素,F-与Na+电子层结构相同,核电荷数越大,离子半径越小,所以离子半径F->Na+,半径较小的是Na+.
故答案为:Na+.
(2)C为氟元素,C的气态氢化物为HF,由于HF中含有氢键相结合的聚合氟化氢分子(HF)n,反应实验室在测定C的气态氢化物的相对分子质量时,发现实际测定值比理论值大出许多.
故答案为:由于HF中含有氢键相结合的聚合氟化氢分子(HF)n.
(3)C为氟元素、D为钠元素,E为铝元素,由晶胞结构可知
 晶胞中,Na+数目为1+4×
晶胞中,Na+数目为1+4× =1.5,阴离子AlF6x-为4×
=1.5,阴离子AlF6x-为4× =0.5,根据电荷守恒可知,1.5=0.5x,所以x=3,所以化学式为Na3AlF6.
=0.5,根据电荷守恒可知,1.5=0.5x,所以x=3,所以化学式为Na3AlF6.故答案为:Na3AlF6.
(4)Mn元素为25号元素,核外电子排布式为[Ar]3d54s2,所以价层电子排布式为3d54s2;由Mn2+转化为Mn3+时,3d能级由较稳定的3d5半充满状态转为不稳定的3d4状态需要的能量较多;而Fe2+到Fe3+时,3d能级由不稳定的3d6到稳定的3d5半充满状态,需要的能量相对要少.
故答案为:3d54s2;由Mn2+转化为Mn3+时,3d能级由较稳定的3d5半充满状态转为不稳定的3d4状态需要的能量较多;而Fe2+到Fe3+时,3d能级由不稳定的3d6到稳定的3d5半充满状态,需要的能量相对要少.
(5)Fe原子或离子外围有较多能量相近的空轨道而能与一些分子或离子形成配合物.
①与Fe原子或离子形成配合物的分子或离子应具有弧对电子.
故答案为:具有弧对电子.
②六氰合亚铁离子(Fe(CN)64-)中的配体CN-中C原子有1对孤对电子对,碳原子与氮原子之间形成C≡N,杂化轨道数为2,碳原子的杂化为sp.与CN-互为等电子体的单质分子有N2等,路易斯结构式 N≡N.
故答案为:sp;N≡N.
点评:题目综合性较大,涉及结构性质与位置关系、元素周期律、晶体结构、化学键等,难度较大,是对所学知识的综合考查与学生能力的考查,注意基础知识的全面掌握.

练习册系列答案
相关题目


 示)位于该正方体的顶点和面心,该化合物的化学式是
示)位于该正方体的顶点和面心,该化合物的化学式是
 [化学一-选修物质结构与性质]周期表中前四周期中的六种元素A、B、C、D、E、F原子序数依次增大,已知A原子2P轨道有3个未成对电子;化合物B2E的晶体为离子晶体,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质的晶体熔点在同周期形成的单质中是最高的;F2+离子核外各亚层电子均已充满.
[化学一-选修物质结构与性质]周期表中前四周期中的六种元素A、B、C、D、E、F原子序数依次增大,已知A原子2P轨道有3个未成对电子;化合物B2E的晶体为离子晶体,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质的晶体熔点在同周期形成的单质中是最高的;F2+离子核外各亚层电子均已充满.