摘要:4.蓝烷分子的化学式为C10H12.其结构简式如右图所示.则其二氯取代物的种数为 A 19 B 20 C 21 D 22 5.已知[Co(NH3)6]3+的主体结构如右图.其中小圆圈表示氨分子.且各相邻的氨分子之间的距离相等.Co3+以位于八面体中心的黑点表示.若其中2个氨分子被Cl-取代.所形成的[Co(NH3)4Cl2] +及4个氨分子被Cl-取代.所形成的[Co(NH3)2Cl4]-的同分异构体的种数分别为 . 都是2种 . 2种和4种 答案1.A 2.C 3D 4.A 5.B 化学反应速率和化学平衡部分
网址:http://m.1010jiajiao.com/timu3_id_350305[举报]
(2008?湖南模拟)下图是某药物中间体(只含C、H、O三种元素)的结构示意图:
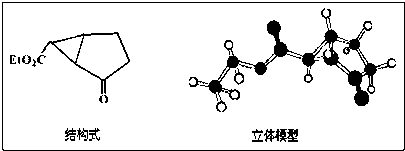
试回答下列问题:
(1)观察上面的结构式与立体模型,通过对比指出结构式中的“Et”表示
(2)请你根据结构示意图,推测该化合物所能发生的反应类型
(3)解决有机分子结构问题的最强有力手段是核磁共振氢谱(PMR).有机化合物分子中有几种化学环境不同的氢原子,在PMR中就有几个不同的吸收峰,吸收峰的面积(强度)与H原子数目成正比.
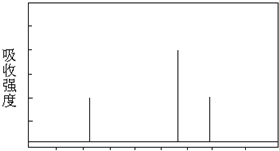
现有一种芳香族化合物与该药物中间体互为同分异构体,其模拟的核磁共振氢谱图如图所示,试写出该化合物的结构简式: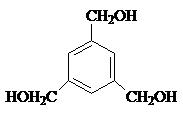
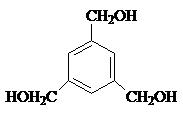 .
.
查看习题详情和答案>>

试回答下列问题:
(1)观察上面的结构式与立体模型,通过对比指出结构式中的“Et”表示
乙基(-CH2CH3)
乙基(-CH2CH3)
;该药物中间体分子的化学式为C9H12O3
C9H12O3
.(2)请你根据结构示意图,推测该化合物所能发生的反应类型
水解反应(或加成反应)
水解反应(或加成反应)
(除燃烧外).(3)解决有机分子结构问题的最强有力手段是核磁共振氢谱(PMR).有机化合物分子中有几种化学环境不同的氢原子,在PMR中就有几个不同的吸收峰,吸收峰的面积(强度)与H原子数目成正比.

现有一种芳香族化合物与该药物中间体互为同分异构体,其模拟的核磁共振氢谱图如图所示,试写出该化合物的结构简式:
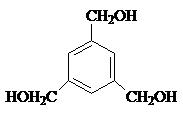
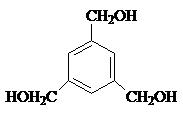
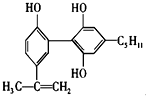 举办“人文亚运”的一个重要体现就是禁止运动员服用兴奋剂.有一种兴奋剂的结构简式如图,下列有关该物质的说法不正确的是( )
举办“人文亚运”的一个重要体现就是禁止运动员服用兴奋剂.有一种兴奋剂的结构简式如图,下列有关该物质的说法不正确的是( )| A、该分子的化学式为C20H24O3 | B、该物质能使酸性KMnO4溶液褪色,即可证明其分子必存在碳碳双键 | C、与足量浓溴水反应时,1mol该物质能与4molBr2反应 | D、该物质属于酚类物质,遇到FeCl3 溶液可发生显色反应 |
 有U、V、W、X、Y、Z、T七种前四周期元素,它们的原子序数依次增大,其相关信息如下表:
有U、V、W、X、Y、Z、T七种前四周期元素,它们的原子序数依次增大,其相关信息如下表:| 元素编号 | 相 关 信 息 |
| U | 其核外电子总数等于其电子层数 |
| V | 基态时,电子分布在三个能级上,且各能级中电子数均相等 |
| W | 其单质是空气的主要成分之一,且化学性质相当稳定 |
| X | 与W元素处于同一周期,且X的第一电离能小于W的第一电离能 |
| Y | 其单质是最强的氧化剂 |
| Z | Z元素的二价阳离子与氩原子的电子层结构相同 |
| T | 是第四周期元素中未成对电子数最多的元素 |
(1)T的基态原子的价电子排布式为
(2)U、V两种元素可组成多种结构的分子.请写出符合下列条件的物质的结构简式:
若化合物V8U8中V元素均采取sp3杂化方式
若化合物V8U8中V元素均采取sp2杂化方式
(3)写出一种与V22-互为等电子体的分子的化学式为
(4)甲和乙分别是W、X元素对应的氢化物,甲和乙中均属于10电子分子,甲极易溶于乙中,原因是
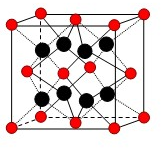
(5)ZY2晶体的晶胞如图所示,Z2+位于晶胞的顶点和面心,则Z2+的配位数为
(2012?开封一模)【选修3-物质结构与性质】
铜在我国有色金属材料的消费中仅次于铝,广泛地应用于电气、机械制造、国防等领域.一项科学研究成果表明,铜锰氧化物(CuMn2O4)能在常温下催化氧化空气中的一氧化碳和甲醛(HCHO).
(1)向一定物质的量浓度的Cu(NO3)2和Mn(NO3)2溶液中加入Na2CO3溶液,所得沉淀经高温灼烧,可制得CuMn2O4.Mn2+基态的电子排布式可表示为
(2)在铜锰氧化物的催化下,CO被氧化成CO2,HCHO被氧化成CO2和H2O.根据等电子原理,CO分子的结构式为
(3)氯和钾与不同价态的铜可生成两种化合物,这两种化合物都可用于催化乙炔聚合,其阴离子均为无限长链结构(如图1),a位置上Cl原子的杂化轨道类型为

(4)用晶体的x射线衍射法可以测得阿伏加德罗常数.对金属铜的测定得到以下结果:晶胞为面心立方最密堆积(如图2),边长为361pm,又知铜的密度为9.00g/cm3,则铜晶胞的体积是
(5)金属铜单独与氨水或单独与过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液反应,其原因是
查看习题详情和答案>>
铜在我国有色金属材料的消费中仅次于铝,广泛地应用于电气、机械制造、国防等领域.一项科学研究成果表明,铜锰氧化物(CuMn2O4)能在常温下催化氧化空气中的一氧化碳和甲醛(HCHO).
(1)向一定物质的量浓度的Cu(NO3)2和Mn(NO3)2溶液中加入Na2CO3溶液,所得沉淀经高温灼烧,可制得CuMn2O4.Mn2+基态的电子排布式可表示为
1s22s22p63s23p63d5
1s22s22p63s23p63d5
,NO-3的空间构型为平面三角形
平面三角形
(用文字描述);(2)在铜锰氧化物的催化下,CO被氧化成CO2,HCHO被氧化成CO2和H2O.根据等电子原理,CO分子的结构式为
C≡O
C≡O
,1molCO2中含有的σ键数目为2NA
2NA
;(3)氯和钾与不同价态的铜可生成两种化合物,这两种化合物都可用于催化乙炔聚合,其阴离子均为无限长链结构(如图1),a位置上Cl原子的杂化轨道类型为
sp3
sp3
,已知其中一种化合物的化学式为KCuCl3,另一种的化学式为K2CuCl3
K2CuCl3
;
(4)用晶体的x射线衍射法可以测得阿伏加德罗常数.对金属铜的测定得到以下结果:晶胞为面心立方最密堆积(如图2),边长为361pm,又知铜的密度为9.00g/cm3,则铜晶胞的体积是
4.7×10-23
4.7×10-23
cm3、晶胞的质量是4.23×10-22
4.23×10-22
g,阿伏加德罗常数为6.01×10-23mol-1
6.01×10-23mol-1
(列式计算);(5)金属铜单独与氨水或单独与过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液反应,其原因是
过氧化氢为氧化剂,氨与Cu2+形成配离子,两者能互相促进使反应进行
过氧化氢为氧化剂,氨与Cu2+形成配离子,两者能互相促进使反应进行
.【化学选修3:物质结构与性质】
A-I为原子序数递增的前4周期的元素,已知A原子的最外层电子是次外层电子数的2倍,D为周期表中电负性最大的元素,F与C位于同一主族,E与G在周期表的位置是上下相连,两元素所在主族中所有元素都是金属,H为应用最广泛的金属;I处于周期表中的第二副族.请回答下列问题:(以下问题中的所有原子都必须在上述元素中寻找)
(1)B单质分子中σ与π键数目比为 ;B、C、D第一电离能由小到大的顺序为 ;(填写元素符号)
(2)H元素原子的价层电子排布式为 ,H3+离子可以与上述元素中的三种形成的某阴离子生成血红色络合物;该阴离子又与A-I元素中的某些原子形成的分子互为等电子体,这种分子的化学式为 (写一种即可),该阴离子空间构型为 ;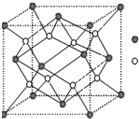
(3)D与G可以形成如图的晶胞,则黑点表示的是 元素(填写元素符号),该元素原子在该晶胞中的配位数为 ;
(4)若将上述晶胞圆圈对应的原子所在上下两层平面原子,按两条相互垂直的对角线上各去掉该原子2个(共去掉4个),并将小点和圆圈对应的元素更改为另外两种元素,则这个晶胞化学式为 ,若再将留下的所有原子换成另外一种新元素的原子,则成为另外一种晶胞,该晶胞中成键原子键角为 ;
(5)已知,F单质晶体的原子堆积为ABAB型,那么,该晶体的空间利用率为 如果F单质的摩尔质量为M,晶胞棱长为a,晶胞高度为c则,该晶体密度表达式为 .(阿伏加德罗常数用NA表示,不化简)如果F的原子半径为R,用R表示的晶胞高度为 .
查看习题详情和答案>>
A-I为原子序数递增的前4周期的元素,已知A原子的最外层电子是次外层电子数的2倍,D为周期表中电负性最大的元素,F与C位于同一主族,E与G在周期表的位置是上下相连,两元素所在主族中所有元素都是金属,H为应用最广泛的金属;I处于周期表中的第二副族.请回答下列问题:(以下问题中的所有原子都必须在上述元素中寻找)
(1)B单质分子中σ与π键数目比为
(2)H元素原子的价层电子排布式为

(3)D与G可以形成如图的晶胞,则黑点表示的是
(4)若将上述晶胞圆圈对应的原子所在上下两层平面原子,按两条相互垂直的对角线上各去掉该原子2个(共去掉4个),并将小点和圆圈对应的元素更改为另外两种元素,则这个晶胞化学式为
(5)已知,F单质晶体的原子堆积为ABAB型,那么,该晶体的空间利用率为