摘要:60毫升由CO2和NO组成的混和气体.通入足量的Na2O2.余气通入足量水.此时无气体剩余.则原混和气体中CO2和NO的体积分别是:D A.各30毫升 B.CO2 :40毫升.NO :20毫升 C.CO2 :24毫升.NO 36毫升 D.CO2 :36毫升.NO :24毫升
网址:http://m.1010jiajiao.com/timu3_id_350061[举报]
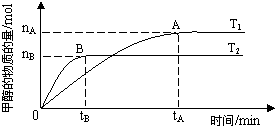
煤的液化是把固体煤炭通过化学加工过程,使其转化成为液体燃料、化工原料和产品的先进洁净煤技术,其中合成CH3OH 是最重要的研究方向之一。在2L的密闭容器中,由CO2和H2合成甲醇CO2(g)+3H2(g) CH3OH(g)+H2O(g),在其他条件不变的情况下,探究温度对反应的影响,实验结果如下图所示(注:T2>T1均大于300℃)。
CH3OH(g)+H2O(g),在其他条件不变的情况下,探究温度对反应的影响,实验结果如下图所示(注:T2>T1均大于300℃)。

①通过分析上图,可以得出对反应CO2(g)+3H2(g) CH3OH(g)+H2O(g)的说法正确的是(填
CH3OH(g)+H2O(g)的说法正确的是(填
序号) 。
A.该反应为放热反应
B.T1时的反应速率大于T2时的反应速率
C.该反应在T1时的平衡常数比T2时的大
D.处于A点的反应体系从T1变到T2,达平衡时n(H2)/n(CH3OH)增大
②下列情形能说明上述反应已达到平衡状态的是 (填序号)
a.体系压强保持不变 b.v(H2)=3v(CO2)
c.CH3OH与H2物质的量之比为1:3 d.每消耗1 mol CO2的同时生成3molH2
e.密闭容器中混合气体的密度不变 f.密闭容器中CH3OH的体积分数不变
③在T1温度时,将2molCO2和6molH2充入该密闭容器中,充分反应达平衡时,若CO2的转化率为60%,则容器内的压强与起始压强之比为 ,该反应的平衡常数为 。
查看习题详情和答案>>
 科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池.已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ?mol-1、-283.0kJ?mol-1和-726.5kJ?mol-1.
科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池.已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ?mol-1、-283.0kJ?mol-1和-726.5kJ?mol-1.请回答下列问题:
(1)用太阳能分解5mol水消耗的能量是
1429
1429
kJ;(2)甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为
CH3OH(l)+O2(g)=CO(g)+2 H2O(l)△H=-443.5kJ?mol-1
CH3OH(l)+O2(g)=CO(g)+2 H2O(l)△H=-443.5kJ?mol-1
;(3)在容积为2L的密闭容器中,由CO2和H2合成甲醇,在其他条件不变得情况下,考察温度对反应的影响,实验结果如图所示(注:T1、T2均大于300℃);
下列说法正确的是
②④
②④
(填序号)①度为T1时,从反应开始到平衡,生成甲醇的平均速率为:v(CH3OH)=
| nA |
| tA |
②该反应为放热反应
③该反应在T1时的平衡常数比T2时的小
④处于A点的反应体系从T1变到T2,达到平衡时
| n(H2) |
| n(CH3OH) |
(4)在T1温度时,将1molCO2和3molH2充入一密闭恒容容器中,充分反应达到平衡后,若CO2转化率为a,则容器内的压强与起始压强之比为
(2-a):2
(2-a):2
.(2012?重庆)尿素[CO(NH2)2]是首个由无机物人工合成的有机物.
(1)工业上尿素由CO2和NH3在一定条件下合成,其反应方程式为
(2)当氨碳比
=4时,CO2的转化率随时间的变化关系如图1所示.
①A点的逆反应速率v逆(CO2)
②NH3的平衡转化率为
(3)人工肾脏可采用间接电化学方法除去代谢产物中的尿素,原理如图2所示.
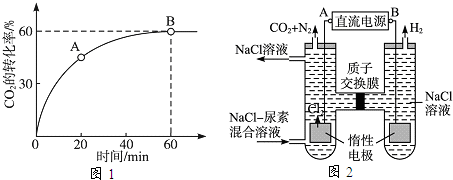
①电源的负极为
②阳极室中发生的反应依次为
③电解结束后,阴极室溶液的pH与电解前相比将
查看习题详情和答案>>
(1)工业上尿素由CO2和NH3在一定条件下合成,其反应方程式为
2NH3+CO2
CO(NH2)2+H2O
| ||
2NH3+CO2
CO(NH2)2+H2O
.
| ||
(2)当氨碳比
| n(NH3) |
| n(CO2) |
①A点的逆反应速率v逆(CO2)
小于
小于
B点的正反应速率v正(CO2)(填“大于”“小于”或“等于”).②NH3的平衡转化率为
30%
30%
.(3)人工肾脏可采用间接电化学方法除去代谢产物中的尿素,原理如图2所示.

①电源的负极为
B
B
(填“A”或“B”).②阳极室中发生的反应依次为
6Cl--6e-═3Cl2↑
6Cl--6e-═3Cl2↑
、CO(NH2)2+3Cl2+H2O═N2+CO2+6HCl
CO(NH2)2+3Cl2+H2O═N2+CO2+6HCl
.③电解结束后,阴极室溶液的pH与电解前相比将
不变
不变
;若两极共收集到气体13.44L(标准状况),则除去的尿素为7.2
7.2
g(忽略气体的溶解).尿素[CO(NH2)2]是首个由无机物人工合成的有机物.
(1)工业上尿素由CO2和NH3在一定条件下合成,其反应方程式为
(2)当氨碳比
=4,时CO2的转化率随时间的变化关系如图1所示.
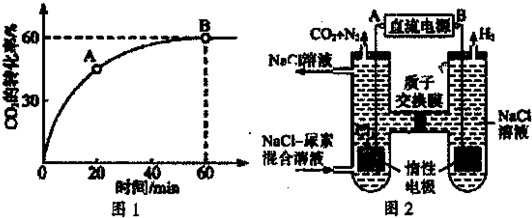
①A点的逆反应速率v逆(CO2)
②反应达到平衡后,NH3的转化率为
(3)人工肾脏可采用间接电化学方法除去代谢产物中的尿素,原理如图2.
①电源的负极为
②阳极室中发生的电极反应为
③电解结束后,阴极室溶液的pH与电解前相比将
查看习题详情和答案>>
(1)工业上尿素由CO2和NH3在一定条件下合成,其反应方程式为
2NH3+CO2
CO(NH2)2+H2O
| 一定条件 |
2NH3+CO2
CO(NH2)2+H2O
.| 一定条件 |
(2)当氨碳比
| n(NH3) |
| n(CO2) |

①A点的逆反应速率v逆(CO2)
小于
小于
B点的正反应速率v正(CO2)(填“<”、“>”或“=”)②反应达到平衡后,NH3的转化率为
30%
30%
.(3)人工肾脏可采用间接电化学方法除去代谢产物中的尿素,原理如图2.
①电源的负极为
B
B
(填“A’或“B”).②阳极室中发生的电极反应为
2Cl--2e-=Cl2↑
2Cl--2e-=Cl2↑
,请用化学方程式描述除去尿素的过程CO(NH2)2+3Cl2+H2O=N2+CO2+6HCl
CO(NH2)2+3Cl2+H2O=N2+CO2+6HCl
.③电解结束后,阴极室溶液的pH与电解前相比将
不变
不变
(填“变大”、“变小”或“不变”);若两极共收集到气体13.44L(标准状况),则除去的尿素为7.2
7.2
g(忽略气体的溶解). 科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池.已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ?mol-1、-283.0kJ?mol-1和-726.5kJ?mol-1.
科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池.已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ?mol-1、-283.0kJ?mol-1和-726.5kJ?mol-1.请回答下列问题:
(1)用太阳能分解10mol水消耗的能量是
2858
2858
kJ;(2)甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为
CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-443.5kJ/mol
CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-443.5kJ/mol
;(3)在容积为2L的密闭容器中,由CO2和H2合成甲醇,在其他条件不变得情况下,考察温度对反应的影响,实验结果如图所示(注:T1、T2均大于300℃);
下列说法正确的是
③④
③④
(填序号)①温度为T1时,从反应开始到平衡,生成甲醇的平均速率为:v(CH3OH)=
| nA |
| tA |
②该反应在T1时的平衡常数比T2时的小
③该反应为放热反应
④处于A点的反应体系从T1变到T2,达到平衡时
| n(H2) |
| n(CH3OH) |
(4)在T1温度时,将1mol CO2和3mol H2充入一密闭恒容器中,充分反应达到平衡后,若CO2转化率为a,则容器内的压强与起始压强之比为
| 2-a |
| 2 |
| 2-a |
| 2 |