题目内容
煤的液化是把固体煤炭通过化学加工过程,使其转化成为液体燃料、化工原料和产品的先进洁净煤技术,其中合成CH3OH 是最重要的研究方向之一。在2L的密闭容器中,由CO2和H2合成甲醇CO2(g)+3H2(g) CH3OH(g)+H2O(g),在其他条件不变的情况下,探究温度对反应的影响,实验结果如下图所示(注:T2>T1均大于300℃)。
CH3OH(g)+H2O(g),在其他条件不变的情况下,探究温度对反应的影响,实验结果如下图所示(注:T2>T1均大于300℃)。

①通过分析上图,可以得出对反应CO2(g)+3H2(g) CH3OH(g)+H2O(g)的说法正确的是(填
CH3OH(g)+H2O(g)的说法正确的是(填
序号) 。
A.该反应为放热反应
B.T1时的反应速率大于T2时的反应速率
C.该反应在T1时的平衡常数比T2时的大
D.处于A点的反应体系从T1变到T2,达平衡时n(H2)/n(CH3OH)增大
②下列情形能说明上述反应已达到平衡状态的是 (填序号)
a.体系压强保持不变 b.v(H2)=3v(CO2)
c.CH3OH与H2物质的量之比为1:3 d.每消耗1 mol CO2的同时生成3molH2
e.密闭容器中混合气体的密度不变 f.密闭容器中CH3OH的体积分数不变
③在T1温度时,将2molCO2和6molH2充入该密闭容器中,充分反应达平衡时,若CO2的转化率为60%,则容器内的压强与起始压强之比为 ,该反应的平衡常数为 。
(共10分)① A C D (3分) ② a d f (3分)③ 7:10 、 0.52 (各2分)
【解析】
试题分析:①根据图像可知,当压强相同时,温度为T2的曲线首先达到平衡状态,这说明温度是T2>T1。但温度高,甲醇的含量低,这说明升高温度平衡向逆反应方向移动,因此正方应是放热反应,即△H<0,A正确;温度是T2>T1,所以T1时的反应速率小于于T2时的反应速率,B不正确;C、升高温度平衡向逆反应方向移动,平衡常数减小,所以该反应在T1时的平衡常数比T2时的大,C正确;处于A点的反应体系从T1变到T2时,平衡向逆反应方向移动,所以达平衡时n(H2)/n(CH3OH)增大,D正确,答案选ACD。
②在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态。a.反应CO2(g)+3H2(g)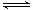 CH3OH(g)+H2O(g)是体积减小的可逆反应,因此体系压强保持不变时可以说明达到平衡状态,a正确;b.反应速率之比是相应的化学计量数之比,因此v(H2)=3v(CO2)是恒成立的,b不正确;c.平衡时浓度不再发生变化,但物质之间的浓度不一定相等或满足某种关系,所以CH3OH与H2物质的量之比为1:3不能说明反应达到平衡状态,c不正确;d.每消耗1 mol CO2的同时生成3molH2,由于二者的反应速率相反,且满足反应速率之比是相应的化学计量数之比,因此可以说明达到平衡状态,d正确;e. 密度是混合气的质量和容器容积的比值,在反应过程中质量和容积始终是不变的,所以密闭容器中混合气体的密度始终不变,e不能说明,e不正确;f.密闭容器中CH3OH的体积分数不变可以说明反应达到平衡状态,f正确,答案选adf。
CH3OH(g)+H2O(g)是体积减小的可逆反应,因此体系压强保持不变时可以说明达到平衡状态,a正确;b.反应速率之比是相应的化学计量数之比,因此v(H2)=3v(CO2)是恒成立的,b不正确;c.平衡时浓度不再发生变化,但物质之间的浓度不一定相等或满足某种关系,所以CH3OH与H2物质的量之比为1:3不能说明反应达到平衡状态,c不正确;d.每消耗1 mol CO2的同时生成3molH2,由于二者的反应速率相反,且满足反应速率之比是相应的化学计量数之比,因此可以说明达到平衡状态,d正确;e. 密度是混合气的质量和容器容积的比值,在反应过程中质量和容积始终是不变的,所以密闭容器中混合气体的密度始终不变,e不能说明,e不正确;f.密闭容器中CH3OH的体积分数不变可以说明反应达到平衡状态,f正确,答案选adf。
③
CO2(g)+3H2(g)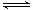 CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
起始浓度(mol/L) 1 3 0 0
转化浓度(mol/L) 0.6 1.8 0.6 0.6
平衡浓度(mol/L) 0.4 1.2 0.6 0.6
所以容器内的压强与起始压强之比为 =
=
该反应的平衡常数K= =
= =0.52
=0.52
考点:考查外界条件对平衡状态的影响、平衡状态的判断以及平衡常数的计算等

| |||||||||||||||||||||||||||
