网址:http://m.1010jiajiao.com/timu3_id_349948[举报]
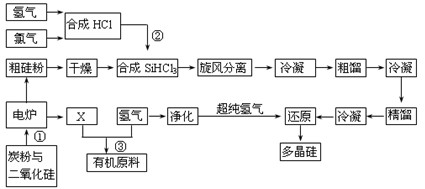
(8分)江苏连云港开发硅产业比较发达,粗硅提纯经常用“三氯氢硅法”。将干燥的硅粉加入合成炉中,与通入的干燥氯化氢气体在280~330℃有氯化亚铜催化剂存在下进行氯化反应,反应气体旋风分离除去杂质,再用氯化钙冷冻盐水将气态三氯氢硅冷凝成液体,经粗馏塔蒸馏和冷凝,除去高沸物和低沸物,再经精馏塔蒸馏和冷凝,得到精制三氯氢硅液体。纯度达到七个“9”以上,杂质含量小于1×10-7,硼要求在0.5×10-9以下。提纯后的三氯氢硅送入不锈钢制的还原炉内,用超纯氢气作还原剂,在1050~1100℃还原成硅,并以硅芯棒为载体沉积而得多晶硅成品。其反应式如下:
Ⅰ H2+Cl2 =" 2HCl"
Ⅱ Si(粗)+3HCl(g)= SiHCl3(l)+H2(g)
Ⅲ SiHCl3(l) +H2(g) = Si(纯)+3HCl(g)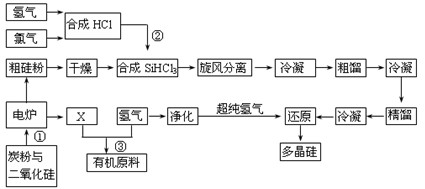
据以上材料回答问题:
(1)电炉中发生反应后排出气体X的成份 (填化学式)。
(2)目前提倡“低碳类经济”,CO2的吸收转化成有机物可有效实现碳循环,是节能减排的有效措施。某物质y的核磁共振氢谱只有一个峰,与CO2可催化加聚生成自然降解的
塑料聚碳酸酯,其反应方程式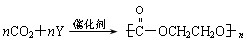 则Y的结构简式为 。
则Y的结构简式为 。
(3)在上述流程中可以循环使用的物质是 。(填名称)
(4)SiH4化学性质比较活泼,它在空气中自燃,有强还原性,在碱存在下迅速水解,由SiH4为原料进行氮化来制备Si3N4纳米材料,则你认为该材料中最大可能存在的杂质
(填化学式)。
(5)已知化学键如表
则下述反应 SiCl4(g)+2H2(g) Si(s)+4HCl(g)
Si(s)+4HCl(g)
该反应的反应热 △H= kJ·mol-1
工业上制氯化铜时,是将浓盐酸用蒸气加热至![]() CuCl2+H2O,FeO+2HCl
CuCl2+H2O,FeO+2HCl![]() FeCl2+H2O。已知:pH≥9.6时,Fe2+以Fe(OH)2的形式完全沉淀;pH≥6.4时,Cu2+以Cu(OH)2的形式完全沉淀;pH在3~4时,Fe3+以Fe(OH)3的形式完全沉淀。?
FeCl2+H2O。已知:pH≥9.6时,Fe2+以Fe(OH)2的形式完全沉淀;pH≥6.4时,Cu2+以Cu(OH)2的形式完全沉淀;pH在3~4时,Fe3+以Fe(OH)3的形式完全沉淀。?
(1).为除去溶液中的Fe2+,可以采用的方法是( )?
A.直接加碱,调整溶液pH≥9.6?
B.加纯铜粉,将Fe2+还原出来?
C.先将Fe2+氧化成Fe3+,再调整pH在3~4?
D.通入硫化氢,使Fe2+直接沉淀?
(2).工业上为除去溶液中的Fe2+,常使用NaClO,当向溶液中加入NaClO后,溶液pH变化情况是( )?
A.肯定减小 B.肯定增大?
C.可能减小 D.可能增大?
(3).若此溶液中只含有Fe3+时,要调整pH在3~4之间,此时最好向溶液中加入( )?
A.NaOH溶液 B.氨水?
C.CuCl2溶液 D.CuO固体?
查看习题详情和答案>>江苏连云港开发硅产业比较发达,粗硅提纯经常用“三氯氢硅法”。将干燥的硅粉加入合成炉中,与通入的干燥氯化氢气体在280~330℃有氯化亚铜催化剂存在下进行氯化反应,反应气体旋风分离除去杂质,再用氯化钙冷冻盐水将气态三氯氢硅冷凝成液体,经粗馏塔蒸馏和冷凝,除去高沸物和低沸物,再经精馏塔蒸馏和冷凝,得到精制三氯氢硅液体。纯度达到七个“9”以上,杂质含量小于1×10-7,硼要求在0.5×10-9以下。提纯后的三氯氢硅送入不锈钢制的还原炉内,用超纯氢气作还原剂,在1050~1100℃还原成硅,并以硅芯棒为载体沉积而得多晶硅成品。其反应式如下:
Ⅰ H2+Cl2 = 2HCl
Ⅱ Si(粗)+3HCl(g)= SiHCl3(l)+H2(g)
Ⅲ SiHCl3(l) +H2(g) = Si(纯)+3HCl(g)
据以上材料回答问题:
(1)电炉中发生反应后排出气体X的成份 (填化学式)。
(2)目前提倡“低碳类经济”,CO2的吸收转化成有机物可有效实现碳循环,是节能减排的有效措施。某物质y的核磁共振氢谱只有一个峰,与CO2可催化加聚生成自然降解的
塑料聚碳酸酯,其反应方程式![]() 则Y的结构简式为 。
则Y的结构简式为 。
(3)在上述流程中可以循环使用的物质是 。(填名称)
(4)SiH4化学性质比较活泼,它在空气中自燃,有强还原性,在碱存在下迅速水解,由SiH4为原料进行氮化来制备Si3N4纳米材料,则你认为该材料中最大可能存在的杂质
(填化学式)。
(5)已知化学键如表

则下述反应 SiCl4(g)+2H2(g)![]() Si(s)+4HCl(g)
Si(s)+4HCl(g)
该反应的反应热 △H= kJ·mol-1
查看习题详情和答案>> (2008?山东)苯丙酸诺龙是一种兴奋剂,结构简式为:
(2008?山东)苯丙酸诺龙是一种兴奋剂,结构简式为:(I)(1)由苯丙酸诺龙的结构推测,它能
a.使溴的四氯化碳溶液褪色 b.使酸性KMnO4溶液褪色
c.与银氨溶液发生银镜反应 d.与Na2CO3溶液作用生成CO2
(II)苯丙酸诺龙的一种同分异构体A,在一定条件下可发生下列反应:

提示:已知反应R-CH2-COOH+Cl2
| 红磷 |
| C | ||
|
据以上信息回答(2)~(4)题:
(2)B→D的反应类型是
(3)C的结构简式为


(4)F→G的化学方程式是


(1)冶炼铜的反应为8CuFeS2+21O2
| ||
若CuFeS2中Fe的化合价为+2,反应中被还原的元素是
(2)下表中,对陈述Ⅰ、Ⅱ的正确性及其有无因果关系的判断都正确的是
| 选项 | 陈述Ⅰ | 陈述Ⅱ | 判断 |
| A | 铜绿的主成分是碱酸铜 | 可用稀盐酸除铜器表面的铜绿 | Ⅰ对;Ⅱ对;有 |
| B | 铜表易形成致密的氧化膜 | 铜容器可以盛放浓硫酸 | Ⅰ对;Ⅱ对;有 |
| C | 铁比铜活泼 | 例在铜板上的铁钉在潮湿空气中不易生锈 | Ⅰ对;Ⅱ对;有 |
| D | 蓝色硫酸铜晶体受热转化为白色硫酸铜粉末是物理变化 | 硫酸铜溶液可用作游泳池的消毒剂 | Ⅰ错;Ⅱ对;无 |
通过改变反应途径,Fe3+、Fe2+均可催化上述反应.试用离子方程式表示Fe3+对上述反应的催化过程.
(4)利用黄铜矿冶炼铜产生的炉渣(含Fe2O3、FeO、SiO2、AI2O3)可制备Fe2O3.方法为
①用稀盐酸浸取炉渣,过滤.
②滤液先氧化,再加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得.
据以上信息回答下列问题:
a.除去AI2O3的离子方程式是
b.选用提供的试剂,设计实验验证炉渣中含有FeO.
提供的试剂:稀盐酸 稀硫酸 KSCN溶液 KMnO4溶液 NaOH溶液 碘水
所选试剂为