题目内容
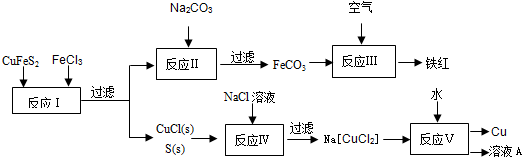
黄铜矿(CuFeS2)是制取铜及其化合物的主要原料之一,还可以制备硫及铁的化合物.
(1)冶炼铜的反应为8CuFeS2+21O2
8Cu+4FeO+2Fe2O3+16SO2
若CuFeS2中Fe的化合价为+2,反应中被还原的元素是
(2)下表中,对陈述Ⅰ、Ⅱ的正确性及其有无因果关系的判断都正确的是
(3)过二硫酸钾(K2S2O8)具有强氧化性,可将I-氧化为I2:S2O82-+2I-=2SO42-+I2
通过改变反应途径,Fe3+、Fe2+均可催化上述反应.试用离子方程式表示Fe3+对上述反应的催化过程.
(4)利用黄铜矿冶炼铜产生的炉渣(含Fe2O3、FeO、SiO2、AI2O3)可制备Fe2O3.方法为
①用稀盐酸浸取炉渣,过滤.
②滤液先氧化,再加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得.
据以上信息回答下列问题:
a.除去AI2O3的离子方程式是
b.选用提供的试剂,设计实验验证炉渣中含有FeO.
提供的试剂:稀盐酸 稀硫酸 KSCN溶液 KMnO4溶液 NaOH溶液 碘水
所选试剂为
(1)冶炼铜的反应为8CuFeS2+21O2
| ||
若CuFeS2中Fe的化合价为+2,反应中被还原的元素是
Cu、O
Cu、O
(填元素符号).(2)下表中,对陈述Ⅰ、Ⅱ的正确性及其有无因果关系的判断都正确的是
AD
AD
(填字母).| 选项 | 陈述Ⅰ | 陈述Ⅱ | 判断 |
| A | 铜绿的主成分是碱酸铜 | 可用稀盐酸除铜器表面的铜绿 | Ⅰ对;Ⅱ对;有 |
| B | 铜表易形成致密的氧化膜 | 铜容器可以盛放浓硫酸 | Ⅰ对;Ⅱ对;有 |
| C | 铁比铜活泼 | 例在铜板上的铁钉在潮湿空气中不易生锈 | Ⅰ对;Ⅱ对;有 |
| D | 蓝色硫酸铜晶体受热转化为白色硫酸铜粉末是物理变化 | 硫酸铜溶液可用作游泳池的消毒剂 | Ⅰ错;Ⅱ对;无 |
通过改变反应途径,Fe3+、Fe2+均可催化上述反应.试用离子方程式表示Fe3+对上述反应的催化过程.
2Fe3++2I-=2Fe2++I2
2Fe3++2I-=2Fe2++I2
、S2O82-+2Fe2+=2SO42-+2Fe3+
S2O82-+2Fe2+=2SO42-+2Fe3+
(不必配平).(4)利用黄铜矿冶炼铜产生的炉渣(含Fe2O3、FeO、SiO2、AI2O3)可制备Fe2O3.方法为
①用稀盐酸浸取炉渣,过滤.
②滤液先氧化,再加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得.
据以上信息回答下列问题:
a.除去AI2O3的离子方程式是
6H++AI2O3=3H2O+2Al3+、Al3++4OH-=2H2O+AlO2-
6H++AI2O3=3H2O+2Al3+、Al3++4OH-=2H2O+AlO2-
.b.选用提供的试剂,设计实验验证炉渣中含有FeO.
提供的试剂:稀盐酸 稀硫酸 KSCN溶液 KMnO4溶液 NaOH溶液 碘水
所选试剂为
稀硫酸、KMnO4溶液
稀硫酸、KMnO4溶液
.证明炉渣中含有的实验现象为稀硫酸浸取炉渣所得溶液使KMnO4溶液褪色
稀硫酸浸取炉渣所得溶液使KMnO4溶液褪色
.分析:(1)反应中化合价降低的元素被还原;
(2)A、铜绿的主成分是碱式碳酸铜,能溶于强酸中;
B、铜易被氧气氧化,金属铜能和浓硫酸反应;
C、铁排在铜的前面,铁比铜活泼;铜板上的铁钉在潮湿空气中容易生锈,铁做负极;
D、硫酸铜晶体失水是化学变化,硫酸铜溶液可用作游泳池的消毒剂,也可以配制波尔多液.
(3)三价铁具有氧化性,能将碘离子氧化;
(4)a、氧化铝是两性氧化物,能和强酸以及强碱反应;
b、亚铁离子能被高锰酸钾溶液氧化,使的高锰酸钾溶液褪色.
(2)A、铜绿的主成分是碱式碳酸铜,能溶于强酸中;
B、铜易被氧气氧化,金属铜能和浓硫酸反应;
C、铁排在铜的前面,铁比铜活泼;铜板上的铁钉在潮湿空气中容易生锈,铁做负极;
D、硫酸铜晶体失水是化学变化,硫酸铜溶液可用作游泳池的消毒剂,也可以配制波尔多液.
(3)三价铁具有氧化性,能将碘离子氧化;
(4)a、氧化铝是两性氧化物,能和强酸以及强碱反应;
b、亚铁离子能被高锰酸钾溶液氧化,使的高锰酸钾溶液褪色.
解答:解:(1)化合价降低的元素Cu、O,在反应中被还原,故答案为:Cu、O;
(2)A、铜绿的主成分是碱式碳酸铜,可用稀盐酸除铜器表面的铜绿是因为它能溶于强酸中,故A正确;
B、铜易被氧气氧化,铜表面易形成致密的氧化膜,金属铜能和浓硫酸反应,铜容器不可以盛放浓硫酸,故B错误;
C、铁排在铜的前面,说明铁比铜活泼,铜板上的铁钉在潮湿空气中形成原电池,铁做负极而易生锈,故C错误;
D、蓝色硫酸铜晶体受热转化为白色硫酸铜粉末是化学变化,硫酸铜溶液可用作游泳池的消毒剂,也可以配制波尔多液,故D正确.
故答案为:AD.
(3)三价铁具有氧化性,能将碘离子氧化,S2O82-能将亚铁离子氧化,原理为:2Fe3++2I-=2Fe2++I2,S2O82-+2Fe2+=2SO42-+2Fe3+,
故答案为:2Fe3++2I-=2Fe2++I2,S2O82-+2Fe2+=2SO42-+2Fe3+;
(4)a:氧化铝是两性氧化物,能和强酸以及强碱反应,故答案为:6H++AI2O3=3H2O+2Al3+、Al3++4OH-=2H2O+AlO2-;
b:高锰酸钾溶液能氧化亚铁离子,使得高锰酸钾溶液褪色,故答案为:稀硫酸、KMnO4溶液;稀硫酸浸取炉渣所得溶液使KMnO4溶液褪色.
(2)A、铜绿的主成分是碱式碳酸铜,可用稀盐酸除铜器表面的铜绿是因为它能溶于强酸中,故A正确;
B、铜易被氧气氧化,铜表面易形成致密的氧化膜,金属铜能和浓硫酸反应,铜容器不可以盛放浓硫酸,故B错误;
C、铁排在铜的前面,说明铁比铜活泼,铜板上的铁钉在潮湿空气中形成原电池,铁做负极而易生锈,故C错误;
D、蓝色硫酸铜晶体受热转化为白色硫酸铜粉末是化学变化,硫酸铜溶液可用作游泳池的消毒剂,也可以配制波尔多液,故D正确.
故答案为:AD.
(3)三价铁具有氧化性,能将碘离子氧化,S2O82-能将亚铁离子氧化,原理为:2Fe3++2I-=2Fe2++I2,S2O82-+2Fe2+=2SO42-+2Fe3+,
故答案为:2Fe3++2I-=2Fe2++I2,S2O82-+2Fe2+=2SO42-+2Fe3+;
(4)a:氧化铝是两性氧化物,能和强酸以及强碱反应,故答案为:6H++AI2O3=3H2O+2Al3+、Al3++4OH-=2H2O+AlO2-;
b:高锰酸钾溶液能氧化亚铁离子,使得高锰酸钾溶液褪色,故答案为:稀硫酸、KMnO4溶液;稀硫酸浸取炉渣所得溶液使KMnO4溶液褪色.
点评:本题是对金属的化学性质的考查,要求学生熟记教材知识,学以致用,综合性较强,难度较大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
黄铜矿(CuFeS2)是制取铜及其化合物的主要原料之一.工业上以黄铜矿为原料,采用火法熔炼工艺生产铜时发生如下反应:2Cu2O+Cu2S
6Cu+SO2↑.
Ⅰ.反应产生的SO2是大气污染物,可用NaOH溶液吸收得到NaHSO3.常温下,0.1mol?L-1NaHSO3溶液的pH小于7,则溶液中c(H2SO3) c(SO32-)(填“>”、“=”或“<”),原因是 .
Ⅱ.黄铜矿熔炼后得到的粗铜含少量Fe、Ag、Au等金属杂质,需进一步采用电解法精制.
(1)请完成下列粗铜电解得到精铜的原理:电解池中 作阴极.
(2)精炼铜产生的废液中含有Fe2+、Fe3+、Cu2+等金属阳离子.已知25℃时如下数据,请完成下列问题:
在25℃下,向浓度均为0.1mol?L-1的FeCl2和CuCl2混合溶液中逐滴加入氨水,先生成 沉淀(填化学式),生成该沉淀的离子方程式为 .
| ||
Ⅰ.反应产生的SO2是大气污染物,可用NaOH溶液吸收得到NaHSO3.常温下,0.1mol?L-1NaHSO3溶液的pH小于7,则溶液中c(H2SO3)
Ⅱ.黄铜矿熔炼后得到的粗铜含少量Fe、Ag、Au等金属杂质,需进一步采用电解法精制.
(1)请完成下列粗铜电解得到精铜的原理:电解池中
(2)精炼铜产生的废液中含有Fe2+、Fe3+、Cu2+等金属阳离子.已知25℃时如下数据,请完成下列问题:
| 物质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
| Ksp | 8.0×10-16 | 2.2×-20 | 4.0×10-38 |