题目内容
根据以下叙述,回答第(1)~(3)题。?工业上制氯化铜时,是将浓盐酸用蒸气加热至![]() CuCl2+H2O,FeO+2HCl
CuCl2+H2O,FeO+2HCl![]() FeCl2+H2O。已知:pH≥9.6时,Fe2+以Fe(OH)2的形式完全沉淀;pH≥6.4时,Cu2+以Cu(OH)2的形式完全沉淀;pH在3~4时,Fe3+以Fe(OH)3的形式完全沉淀。?
FeCl2+H2O。已知:pH≥9.6时,Fe2+以Fe(OH)2的形式完全沉淀;pH≥6.4时,Cu2+以Cu(OH)2的形式完全沉淀;pH在3~4时,Fe3+以Fe(OH)3的形式完全沉淀。?
(1).为除去溶液中的Fe2+,可以采用的方法是( )?
A.直接加碱,调整溶液pH≥9.6?
B.加纯铜粉,将Fe2+还原出来?
C.先将Fe2+氧化成Fe3+,再调整pH在3~4?
D.通入硫化氢,使Fe2+直接沉淀?
(2).工业上为除去溶液中的Fe2+,常使用NaClO,当向溶液中加入NaClO后,溶液pH变化情况是( )?
A.肯定减小 B.肯定增大?
C.可能减小 D.可能增大?
(3).若此溶液中只含有Fe3+时,要调整pH在3~4之间,此时最好向溶液中加入( )?
A.NaOH溶液 B.氨水?
C.CuCl2溶液 D.CuO固体?
(1)解析:A选项中,pH≥9.6时,Cu2+已被沉淀完全;D选项中,H2S和Fe2+不反应。??
答案:C?
(2)解析:发生反应的离子方程式为:2Fe2++ClO-+H2O![]() 2Fe3++Cl-+2OH-,所以溶液的pH增大。
2Fe3++Cl-+2OH-,所以溶液的pH增大。
答案:B?
(3)解析:本着除杂的基本原则不再引入新的杂质,故A、B排除。C中CuCl2不与H+发生反应,所以不能调节溶液的pH。?
答案:D

 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案能源可划分为一级能源和二级能源.自然界中以现成形式提供的能源称为一级能源;需依靠其它能源的能量间接制取的能源称为二级能源.氢气是一种高效而没有污染的二级能源,它可以由自然界中大量存在的水来制取:2H2O(液)=2H2(气)+O2(气)-517.6千焦下列叙述正确的是( )
| A、电能是二级能源 | B、水力是二级能源 | C、天然气是一级能源 | D、焦炉气是一级能源 |
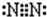
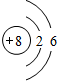
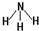
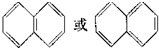 根据以下叙述,回答第18和19题
根据以下叙述,回答第18和19题