网址:http://m.1010jiajiao.com/timu3_id_349636[举报]
0℃,1.01×105Pa时,分别向甲、乙、丙三个容器中加入30.0mL同浓度的盐酸,
| 反应容器 | 甲 | 乙 | 丙 | |
| 加入合金质量(g) | 0.510 | 1.53 | 3.57 | |
| 与盐酸反应生成气体(L) | 0.560 | 0.672 | 0.672 | |
| 与氢氧化钠反应产生气体(L) | 0.336 | x | y |
再加入不同质量的由两种金属组成的合金粉末,测量放出气体的体积。若在甲、乙、丙三个容器中加入与盐酸同体积同浓度的氢氧化钠溶液,再分别加入与上述实验相同质量的同种合金,测量放出气体的体积,如下表:
根据表中数据可以计算得出的是_________;
A.合金的组成 B.合金中组分的含量
C.盐酸的物质的量浓度 D.盐酸的密度
能计算出的量的值为__________________;
(2)若两种金属是下列选项中的某两种,则从甲容器中的两次实验:
①不经计算,肯定没有________________(填字母符号);
A.40Ca B.56Fe C.64Cu D.24Mg E.27Al
②通过计算讨论推测合金的成分____________;
(3)根据(2)的推测结果,计算x和y的值分别为多少?
查看习题详情和答案>>| 反应容器 | 甲 | 乙 | 丙 | |
| 加入合金质量(g) | 0.510 | 1.53 | 3.57 | |
| 与盐酸反应生成气体(L) | 0.560 | 0.672 | 0.672 | |
| 与氢氧化钠反应产生气体(L) | 0.336 | x | y | |
再加入不同质量的由两种金属组成的合金粉末,测量放出气体的体积。若在甲、乙、丙三个容器中加入与盐酸同体积同浓度的氢氧化钠溶液,再分别加入与上述实验相同质量的同种合金,测量放出气体的体积,如下表:
根据表中数据可以计算得出的是_________;
A.合金的组成 B.合金中组分的含量
C.盐酸的物质的量浓度 D.盐酸的密度
能计算出的量的值为__________________;
(2)若两种金属是下列选项中的某两种,则从甲容器中的两次实验:
①不经计算,肯定没有________________(填字母符号);
A.40Ca B.56Fe C.64Cu D.24Mg E.27Al
②通过计算讨论推测合金的成分____________;
(3)根据(2)的推测结果,计算x和y的值分别为多少?
0℃,1.01×105Pa时,分别向甲、乙、丙三个容器中加入30.0mL同浓度的盐酸,
| 反应容器 | 甲 | 乙 | 丙 | |
| 加入合金质量(g) | 0.510 | 1.53 | 3.57 | |
| 与盐酸反应生成气体(L) | 0.560 | 0.672 | 0.672 | |
| 与氢氧化钠反应产生气体(L) | 0.336 | x | y |
再加入不同质量的由两种金属组成的合金粉末,测量放出气体的体积。若在甲、乙、丙三个容器中加入与盐酸同体积同浓度的氢氧化钠溶液,再分别加入与上述实验相同质量的同种合金,测量放出气体的体积,如下表:
根据表中数据可以计算得出的是________;
A.合金的组成 B.合金中组分的含量
C.盐酸的物质的量浓度 D.盐酸的密度
能计算出的量的值为________;
(2)若两种金属是下列选项中的某两种,则从甲容器中的两次实验:
①不经计算,肯定没有________(填字母符号);
A.40Ca B.56Fe C.64Cu D.24Mg E.27Al
②通过计算讨论推测合金的成分________;
(3)根据(2)的推测结果,计算x和y的值分别为多少?
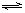 2SO3(g),达到平衡时,SO3的体积分数为0.91。
2SO3(g),达到平衡时,SO3的体积分数为0.91。(1)从理论上看,增大压强,平衡向正反应方向移动,SO2的转化率增大。但工业上二氧化硫催化氧化采用常压而不用高压,主要的原因是_____________。
(2)保持上述温度和压强不变,若向容器中只充入2molSO3,并加入固体催化剂,则平衡时SO2的体积分数是_______,平衡时混合气体的体积是__________。
(3)温度仍保持537℃,容器的体积保持200L不变。充入amolSO2和bmolO2,并加入固体催化剂,反应达到平衡时,SO3的体积分数仍为0.91,体系压强为1.01×105Pa。若a∶b=2∶1,则a=________。 查看习题详情和答案>>
联氨(N2H4)及其衍生物是一类重要的火箭燃料。N2H4与N2O4反应能放出大量的热。
(1)已知:2NO2(g) N2O4(g) △H=-57.20kJ·mol-1。一定温度下,在密闭容器中此反应达到平衡。 其他条件不变时,下列措施不能使NO2转化率提高的是
N2O4(g) △H=-57.20kJ·mol-1。一定温度下,在密闭容器中此反应达到平衡。 其他条件不变时,下列措施不能使NO2转化率提高的是
| A.减少NO2的浓度 | B.降低温度 | C.增加NO2的浓度 | D.升高温度 |
(3)17℃、1.01×105Pa,密闭容器中N2O4和NO2的混合气体达到平衡时,c(NO2)="0.0300" mol·L-1、c(N2O4)="0.0120" mol·L-1。计算反应2NO2(g)
 N2O4(g)的平衡常数K= 。
N2O4(g)的平衡常数K= 。(4)肼易溶于水,它是与氨类似的弱碱,用电离方程式表示肼的水溶液显碱性的原因 。
(5)已知在相同条件下N2H4?H2O的电离程度大于N2H5C1的水解程度。常温下,若将0.2mol/L N2H4?H2O溶液与0.1mol/L HCl溶液等体积混合,则溶液中N2H5+、Cl-、OH-、H+离子浓度由大到小的顺序为:__________。
(6)肼-空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液.肼-空气燃料电池放电时,负极的电极反应式是 ,电池工作一段时间后,电解质溶液的pH将 (填“增大”、“减小”、“不变”)。 查看习题详情和答案>>