摘要:19.为测定硫酸铵和氯化铵固体混合物中氯化铵的质量分数.甲.乙两位同学按下列所示的实验步骤进行实验:称量样品.溶解.加过量试剂A.过滤出沉淀B.洗涤沉淀.烘干称量.处理实验数据.得出结果. ⑴实验时.甲同学选用硝酸银溶液作试剂A.乙同学选用氯化钡溶液作试剂A.其中 填同学选择的试剂A不合理.其理由是 ⑵以下都是试剂A选择正确时进行的实验: ①为进行称量.溶解.反应.过滤.洗涤沉淀的各项操作.准备了以下仪器:托盘天平与砝码.过滤器.铁架台及附件.胶头滴管.量筒.其中还缺少的必备仪器是 . ②若过滤所得沉淀未经洗涤即烘干称量.测出的氯化铵的质量分数 (填“偏高 .“偏低 或“不变 ). ③检验加入的试剂A是否过量的方法是 .
网址:http://m.1010jiajiao.com/timu3_id_349318[举报]
为测定硫酸铵和氯化铵固体混合物中氯化铵的质量分数,甲、乙两位同学按下列所示的实验步骤进行实验:称量样品、溶解、加过量试剂A、过滤出沉淀B、洗涤沉淀、烘干称量、处理实验数据,得出结果。?
(1)实验时,甲同学选用硝酸银溶液作试剂A,乙同学选用氯化钡溶液作试剂A,其中________ (填“甲”或“乙”)同学选择的试剂A不合理,其理由是 。?
(2)以下都是正确选择试剂A时进行的实验:?
①为进行称量、溶解、反应、过滤、洗涤沉淀的各项操作,准备了以下仪器:托盘天平与砝码、过滤器、铁架台及附件、胶头滴管、量筒,其中还缺少的必备仪器是 。?
②若过滤所得沉淀未经洗涤即烘干称量,测出的氯化铵的质量分数 (填“偏高”“偏低”或“不变”)。?
③检验加入的试剂A是否过量的方法是 。?
查看习题详情和答案>>(1)研究硫及其化合物性质有重要意义.
硫酸工业生产中涉及如下反应:2SO2(g)+O2(g)═2SO3(g).向2L的容器中充入2mol SO2、1mol O2,SO2的平衡转化率与温度的关系如图所示.T1温度时反应进行到状态D时,v(正)______v(逆)(填“>”、“<”或“=”).温度为T1时,反应的平衡常数K=______.(单位必须写),若在T3温度时,达平衡时测得反应放出的热量为Q1.此时再向容器中加入2mol SO2、1mol O2并使之重新达到平衡,测得又放出热量Q2.则下列说法正确的是______.(填字母编号)
a.容器的压强增大原来的两倍b.Q2一定等于Q1
c.新平衡时SO2的转化率一定大于80% d.T3时的平衡常数大于T1时的平衡常数
(2)已知:25℃时,Ksp[Mg(OH)2]=5.6×10-12,Ksp(MgF2)=7.4×10-11.25℃时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)______(填增大、减小或不变);在等浓度的KOH和KF混合溶液中加入稀MgCl2溶液,首先生成的沉淀是______(写化学式).
(3)Al2(SO4)3溶液显示酸性,其原因是______(写离子方程式),向某酸化的Al2(SO4)3溶液中加入NaHCO3固体,出现的现象是:有大量气体产生,同时有白色沉淀,试用平衡移动原理解释原因:______.
(4)加热蒸发下列溶液,能析出得到原溶质的是______.
a.KNO3溶液b.AlCl3溶液c.Al2(SO4)3溶液d.盐酸
(5)25℃时,pH为4的氯化铵溶液和pH为4盐酸溶液中,由水电离出的H+浓度之比为______.

查看习题详情和答案>>
硫酸工业生产中涉及如下反应:2SO2(g)+O2(g)═2SO3(g).向2L的容器中充入2mol SO2、1mol O2,SO2的平衡转化率与温度的关系如图所示.T1温度时反应进行到状态D时,v(正)______v(逆)(填“>”、“<”或“=”).温度为T1时,反应的平衡常数K=______.(单位必须写),若在T3温度时,达平衡时测得反应放出的热量为Q1.此时再向容器中加入2mol SO2、1mol O2并使之重新达到平衡,测得又放出热量Q2.则下列说法正确的是______.(填字母编号)
a.容器的压强增大原来的两倍b.Q2一定等于Q1
c.新平衡时SO2的转化率一定大于80% d.T3时的平衡常数大于T1时的平衡常数
(2)已知:25℃时,Ksp[Mg(OH)2]=5.6×10-12,Ksp(MgF2)=7.4×10-11.25℃时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)______(填增大、减小或不变);在等浓度的KOH和KF混合溶液中加入稀MgCl2溶液,首先生成的沉淀是______(写化学式).
(3)Al2(SO4)3溶液显示酸性,其原因是______(写离子方程式),向某酸化的Al2(SO4)3溶液中加入NaHCO3固体,出现的现象是:有大量气体产生,同时有白色沉淀,试用平衡移动原理解释原因:______.
(4)加热蒸发下列溶液,能析出得到原溶质的是______.
a.KNO3溶液b.AlCl3溶液c.Al2(SO4)3溶液d.盐酸
(5)25℃时,pH为4的氯化铵溶液和pH为4盐酸溶液中,由水电离出的H+浓度之比为______.

下列有关实验的叙述正确的是
| A.已知Cu2O+2H+=Cu2++Cu+H2O,氢气还原氧化铜后生成的红色固体能完全溶于稀硝酸,说明还原产物是铜 |
| B.在中和热测定的实验中,将NaOH溶液和盐酸混合反应后的冷却温度作为末温度 |
| C.仅用淀粉溶液、稀硫酸、碘水、新制氢氧化铜四种试剂可完成淀粉水解产物及水解程度检验的探究实验 |
| D.向盛有少量Mg(OH )2悬浊液的试管中滴加氯化铵溶液,可以看到沉淀溶解 |
下列有关实验的叙述正确的是
| A.已知Cu2O+2H+=Cu2++Cu+H2O,氢气还原氧化铜后生成的红色固体能完全溶于稀硝酸,说明还原产物是铜 |
| B.在中和热测定的实验中,将NaOH溶液和盐酸混合反应后的冷却温度作为末温度 |
| C.仅用淀粉溶液、稀硫酸、碘水、新制氢氧化铜四种试剂可完成淀粉水解产物及水解程度检验的探究实验 |
| D.向盛有少量Mg(OH )2悬浊液的试管中滴加氯化铵溶液,可以看到沉淀溶解 |
某校化学研究性学习小组的同学在学习了氨的性质后,讨论NH3能否还原CuO,设计实验来研究这个问题.
(1)①实验室常用加热氯化铵固体和氢氧化钙固体混合物的方法来制取氨气,写出反应的化学方程式: .
②实验室还可用 和浓氨水快速制取少量氨气.
(2)该小组成员设计实验探究氨气的还原性及其产物,实验装置(夹持及尾气处理装置未画出)如图所示.
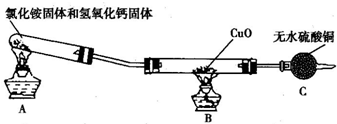
①该装置在设计上有一定的缺陷,为确保实验结果的准确性,你对该装置改进的措施是 .
②利用改进后的装置进行实验,观察到CuO变为红色物质,无水CuSO4变蓝,同时生成一种无污染的气体.请写出NH3与CuO反应的化学方程式: .
(3)该小组成员用氨气还原氧化铜的方法测定铜的近似相对原子质量,如果选用测定反应物CuO和生成物H2O的质量[m(CuO)、m(H2O)]时,请用下图所示的仪器设计一个简单的实验方案.
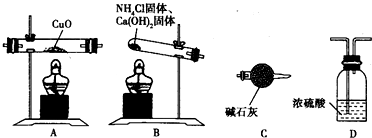
①仪器连接的顺序是 (填编号,仪器可重复使用);
②D中浓硫酸的作用是 ;
③列出计算铜的近似相对原子质量的表达式: .
查看习题详情和答案>>
(1)①实验室常用加热氯化铵固体和氢氧化钙固体混合物的方法来制取氨气,写出反应的化学方程式:
②实验室还可用
(2)该小组成员设计实验探究氨气的还原性及其产物,实验装置(夹持及尾气处理装置未画出)如图所示.

①该装置在设计上有一定的缺陷,为确保实验结果的准确性,你对该装置改进的措施是
②利用改进后的装置进行实验,观察到CuO变为红色物质,无水CuSO4变蓝,同时生成一种无污染的气体.请写出NH3与CuO反应的化学方程式:
(3)该小组成员用氨气还原氧化铜的方法测定铜的近似相对原子质量,如果选用测定反应物CuO和生成物H2O的质量[m(CuO)、m(H2O)]时,请用下图所示的仪器设计一个简单的实验方案.

①仪器连接的顺序是
②D中浓硫酸的作用是
③列出计算铜的近似相对原子质量的表达式: