摘要:证明KClO3的成分里含有钾.氧和氯三种元素.
网址:http://m.1010jiajiao.com/timu3_id_348975[举报]
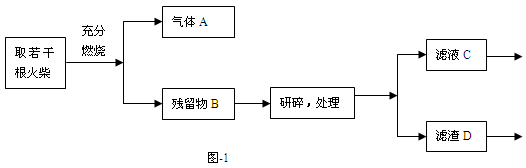
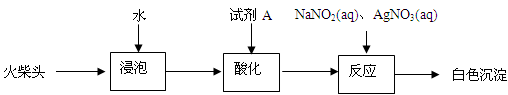
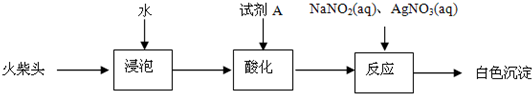
(2013?普陀区二模)某化学小组同学为了验证日常生活所用火柴头中的化学成分(含KClO3、MnO2、S等),设计了以下实验流程(见图-1);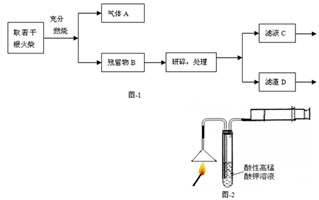
试回答以下问题:
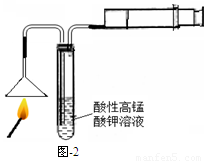
(1)燃着的火柴按图-2进行实验,若试管中能观察到
含有硫元素.图中针筒的作用是
(2)为了证明火柴头中含有氯元素,后续的实验步骤是
(3)有同学提出检验火柴头中KClO3的另一实验方案:
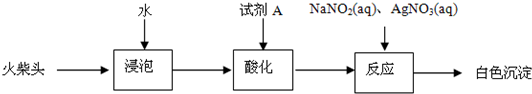
试剂A为
(4)设计实验:简述验证滤渣D中含有MnO2的一个实验方案,并写出有关反应的化学方程式.
查看习题详情和答案>>

试回答以下问题:
(1)燃着的火柴按图-2进行实验,若试管中能观察到
KMnO4溶液褪色
KMnO4溶液褪色
的现象,则可证明火柴头中含有硫元素.图中针筒的作用是
使燃烧产生的气体顺利进入试管
使燃烧产生的气体顺利进入试管
.(2)为了证明火柴头中含有氯元素,后续的实验步骤是
取少量滤液C置于试管中,先后加入HNO3、AgNO3溶液,若观察到白色沉淀产生,即可证明火柴头中含有氯元素
取少量滤液C置于试管中,先后加入HNO3、AgNO3溶液,若观察到白色沉淀产生,即可证明火柴头中含有氯元素
.(3)有同学提出检验火柴头中KClO3的另一实验方案:

试剂A为
硝酸(或HNO3)
硝酸(或HNO3)
,加入NaNO2的目的是还原KClO3
还原KClO3
.(4)设计实验:简述验证滤渣D中含有MnO2的一个实验方案,并写出有关反应的化学方程式.
取少量滤渣D加入装有少量H2O2的试管中,有大量气泡放出说明含有MnO2、2H2O2
2H2O+O2↑(或其他正确答案)
| MnO2 |
取少量滤渣D加入装有少量H2O2的试管中,有大量气泡放出说明含有MnO2、2H2O2
2H2O+O2↑(或其他正确答案)
.| MnO2 |
某化学小组同学为了验证日常生活所用火柴头中的化学成分(含KClO3、MnO2、S等),设计了以下实验流程(见图-1):
试回答以下问题:
(1)燃着的火柴按图-2进行实验,若试管中能观察到 的现象,则可证明火柴头中含有硫元素。图中针筒的作用是 。
(2)为了证明火柴头中含有氯元素,后续的实验步骤是 。
(3)有同学提出检验火柴头中KClO3的另一实验方案:
试剂A为 ,加入NaNO2的目的是 。
(4)设计实验:简述验证滤渣D中含有MnO2的一个实验方案,并写出有关反应的化学方程式。 。
查看习题详情和答案>>
在实验室里可用如图所示装置制取氯酸钾、次氯酸钠和探究氯水的性质.

图甲中:①为氯气发生装置;②的试管里盛有15mL 30% KOH溶液,并置于水浴中;③的试管里盛有15mL 8% NaOH溶液,并置于冰水浴中;④的试管里加有紫色石蕊试液;⑤为尾气吸收装置.请填写下列空白:
(1)装置①是氯气发生装置,蒸馏烧瓶中盛放MnO2固体,其反应的化学方程式为______.
(2)工业上常用氯气与熟石灰反应制漂白粉,漂白粉的有效成分为______(填化学式).
(3)比较制取氯酸钾和次氯酸钠的条件,二者的差异是______.
(4)反应完毕经冷却后,②的试管中有大量晶体析出.图乙中符合该晶体溶解度曲线的是______(填写编号字母);从②的试管中分离出该晶体的方法是______(填写实验操作名称).
(5)根据④的试管里紫色石蕊试液的颜色变化可否证明氯气的强氧化性______.为什么?______.
(6)若②的试管溶液中不但有KClO3生成还有KClO生成,且二者的物质的量之比为1:2,则该反应中氧化剂和还原剂的物质的量之比为:______.
查看习题详情和答案>>
某化学小组同学为了验证日常生活所用火柴头中的化学成分(含KClO3、MnO2、S等),设计了以下实验流程(见图-1);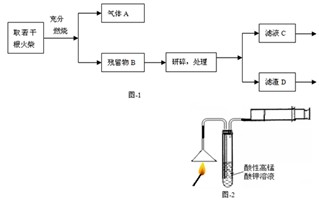
试回答以下问题:
(1)燃着的火柴按图-2进行实验,若试管中能观察到______的现象,则可证明火柴头中
含有硫元素.图中针筒的作用是______.
(2)为了证明火柴头中含有氯元素,后续的实验步骤是______.
(3)有同学提出检验火柴头中KClO3的另一实验方案:
试剂A为______,加入NaNO2的目的是______.
(4)设计实验:简述验证滤渣D中含有MnO2的一个实验方案,并写出有关反应的化学方程式.______.
查看习题详情和答案>>
某酸性腐蚀液中含有大量CuCl2、FeCl2、FeCl3,任意排放会造成环境污染及资源的浪费.以废腐蚀液为原料,回收铜并将铁的化合物全部转化为FeCl3溶液.
测得某酸性废腐蚀液中含CuCl2 1.5mol/L,FeCl2 3mol/L,FeCl3 1mol/L,HCl 1mol/L.
取该酸性废腐蚀液200mL,按如下流程在实验室进行实验:
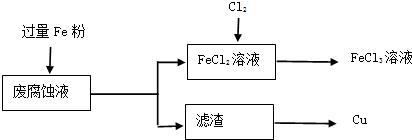
(1)腐蚀液中加入过量Fe粉,发生反应的离子方程式为 .
(2)检验废腐蚀液中含有Fe3+的实验操作是取少量废腐蚀液于试管中,滴加几滴KSCN溶液,溶液 ,则证明原溶液中含有Fe3+.
(3)滤渣的主要成分是 (填化学式).由滤渣得到铜除杂所需试剂是 .
(4)FeCl2溶液中通入Cl2,发生反应的化学方程式为 .
(5)实验室用固体KClO3与浓HCl反应制Cl2,反应的化学方程式为:KClO3+6HCl(浓)═KCl+3Cl2+3H2O若反应生成6.72L(标准状况)Cl2,转移的电子数为 mol.
(6)按上述流程操作,加入Fe粉的质量应不少于 g.
查看习题详情和答案>>
测得某酸性废腐蚀液中含CuCl2 1.5mol/L,FeCl2 3mol/L,FeCl3 1mol/L,HCl 1mol/L.
取该酸性废腐蚀液200mL,按如下流程在实验室进行实验:

(1)腐蚀液中加入过量Fe粉,发生反应的离子方程式为
(2)检验废腐蚀液中含有Fe3+的实验操作是取少量废腐蚀液于试管中,滴加几滴KSCN溶液,溶液
(3)滤渣的主要成分是
(4)FeCl2溶液中通入Cl2,发生反应的化学方程式为
(5)实验室用固体KClO3与浓HCl反应制Cl2,反应的化学方程式为:KClO3+6HCl(浓)═KCl+3Cl2+3H2O若反应生成6.72L(标准状况)Cl2,转移的电子数为
(6)按上述流程操作,加入Fe粉的质量应不少于