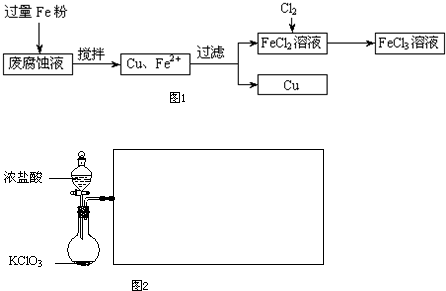
��Ŀ����
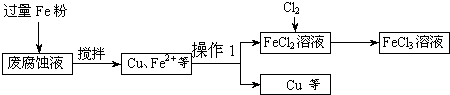
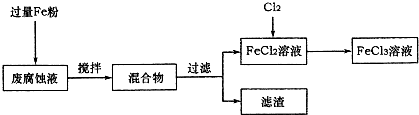
ij���Ը�ʴҺ�к��д���CuCl2��FeCl2��FeCl3�������ŷŻ���ɻ�����Ⱦ����Դ���˷ѣ��Էϸ�ʴҺΪԭ�ϣ�����ͭ�������Ļ�����ȫ��ת��ΪFeCl3��Һ�����ij���Էϸ�ʴҺ�к�CuCl2 1.5mol/L��FeCl2 3mol/L��FeCl3 1mol/L��HCl 1mol/L��
ȡ�����Էϸ�ʴҺ200mL��������������ʵ���ҽ���ʵ�飺
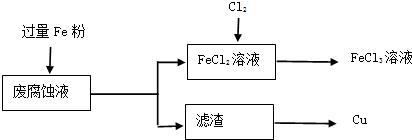
��1����ʴҺ�м������Fe�ۣ�������Ӧ�����ӷ���ʽΪ
��2������ϸ�ʴҺ�к���Fe3+��ʵ�������ȡ�����ϸ�ʴҺ���Թ��У��μӼ���KSCN��Һ����Һ
��3����������Ҫ�ɷ���
��4��FeCl2��Һ��ͨ��Cl2��������Ӧ�Ļ�ѧ����ʽΪ
��5��ʵ�����ù���KClO3��ŨHCl��Ӧ��Cl2����Ӧ�Ļ�ѧ����ʽΪ��KClO3+6HCl��Ũ���TKCl+3Cl2+3H2O����Ӧ����6.72L����״����Cl2��ת�Ƶĵ�����Ϊ
��6�����������̲���������Fe�۵�����Ӧ������
��������1��ӡˢ��·�ķϸ�ʴҺ�е�CuCl2��FeCl3�����۷�Ӧ����Fe2+��Cu��
��2��Fe3+�ļ��飺���������ӵ���Һ�еμӼ���KSCN��Һ����Һ��죻
��3�������к���Fe��Cu����ȥ���е�Feѡ�����
��4����������ǿ�����ԣ��Ȼ�������Һͨ�������õ����Ȼ�����Һ��
��5��ͨ����ѧ����ʽ�����ת�Ƶ��Ӻ�Cl2�Ļ�ѧ�������ı�ֵ��ϵ���������Cl2�����ʵ��������ȱȼ��㼴�ɣ�
��6��ͨ��2Fe3++Fe=3Fe2+��Fe+Cu2+=Fe2++Cu��Fe+2H+=Fe2++H2�����㼴�ɣ�
��2��Fe3+�ļ��飺���������ӵ���Һ�еμӼ���KSCN��Һ����Һ��죻
��3�������к���Fe��Cu����ȥ���е�Feѡ�����
��4����������ǿ�����ԣ��Ȼ�������Һͨ�������õ����Ȼ�����Һ��
��5��ͨ����ѧ����ʽ�����ת�Ƶ��Ӻ�Cl2�Ļ�ѧ�������ı�ֵ��ϵ���������Cl2�����ʵ��������ȱȼ��㼴�ɣ�
��6��ͨ��2Fe3++Fe=3Fe2+��Fe+Cu2+=Fe2++Cu��Fe+2H+=Fe2++H2�����㼴�ɣ�
����⣺��1��ӡˢ��·�ķϸ�ʴҺ�е�CuCl2��FeCl3�����۷�Ӧ����Fe2+��Cu��CuCl2�����۷�Ӧ�����ӷ���ʽΪ��Fe+Cu2+=Fe2++Cu��FeCl3�����۷�Ӧ�����ӷ���ʽΪ��2Fe3++Fe=3Fe2+��
�ʴ�Ϊ��2Fe3++Fe=3Fe2+��Fe+Cu2+=Fe2++Cu��
��2��������Һ��Fe3+����ͨ����KSCN��Һ��ȡ������Һ���Թ��У��μ�KSCN��Һ��������ӦFe3++3SCN-?Fe��SCN��3����Һ��죬˵��Fe3+���ڣ�
�ʴ�Ϊ����죻
��3�������к��й���������Fe�ͷ�ӦFe+Cu2+=Fe2++Cu���ɵ�Cu����Ҫ��ȥ���е�Feѡ�����ᣬȻ����ˣ�
�ʴ�Ϊ��Fe��Cu�����
��4����������ǿ�����ԣ��Ȼ�������Һͨ�������õ����Ȼ�����Һ���䷴Ӧ�Ļ�ѧ����ʽΪ��2FeCl2+C12=2FeCl3��
�ʴ�Ϊ��2FeCl2+C12=2FeCl3��
��5��n��Cl2��=
=0.3mol����KClO3+6HCl=KCl+3Cl2��+3H2O�л��ϼ۵ı仯��ֻ֪��ClԪ�ػ��ϼ۷����仯������KClO3Ϊ��������HClΪ��ԭ��������6��HCl�μӷ�Ӧʱ��5��HCl����ԭ����ʧȥ5�����ӣ���ת�Ƶ�����Ϊ5����˿��Եõ���ϵʽ��5e-��3Cl2����˵�����0.3mol������ת�Ƶĵ��ӵ����ʵ���Ϊ��0.3mol��
=0.5mol��
�ʴ�Ϊ��0.5��
��6����Һ�к���Cu2+0.3mol��Fe3+0.2mol��H+0.2mol�����ĵ����۷ֱ�Ϊ��0.3mol��0.1mol��0.1mol����Ҫ��ͭȫ�����գ������Fe�۵�����Ӧ������0.5mol��56g/mol=28g��
�ʴ�Ϊ��28��
�ʴ�Ϊ��2Fe3++Fe=3Fe2+��Fe+Cu2+=Fe2++Cu��
��2��������Һ��Fe3+����ͨ����KSCN��Һ��ȡ������Һ���Թ��У��μ�KSCN��Һ��������ӦFe3++3SCN-?Fe��SCN��3����Һ��죬˵��Fe3+���ڣ�
�ʴ�Ϊ����죻
��3�������к��й���������Fe�ͷ�ӦFe+Cu2+=Fe2++Cu���ɵ�Cu����Ҫ��ȥ���е�Feѡ�����ᣬȻ����ˣ�
�ʴ�Ϊ��Fe��Cu�����
��4����������ǿ�����ԣ��Ȼ�������Һͨ�������õ����Ȼ�����Һ���䷴Ӧ�Ļ�ѧ����ʽΪ��2FeCl2+C12=2FeCl3��
�ʴ�Ϊ��2FeCl2+C12=2FeCl3��
��5��n��Cl2��=
| 6.72L |
| 22.4mol/L |
| 5 |
| 3 |
�ʴ�Ϊ��0.5��
��6����Һ�к���Cu2+0.3mol��Fe3+0.2mol��H+0.2mol�����ĵ����۷ֱ�Ϊ��0.3mol��0.1mol��0.1mol����Ҫ��ͭȫ�����գ������Fe�۵�����Ӧ������0.5mol��56g/mol=28g��
�ʴ�Ϊ��28��
������������ʵ�����ʽ��������ķ��롢�ᴿ��ע�ⷢ���Ļ�ѧ��Ӧ�����ǽ����Ĺؼ�����5��Ϊѧ�������״�����ѵ㣬��Ŀ�Ѷ��еȣ�

��ϰ��ϵ�д�
 �߲������Ӧ��һ��ͨϵ�д�
�߲������Ӧ��һ��ͨϵ�д�
�����Ŀ