网址:http://m.1010jiajiao.com/timu3_id_348819[举报]
(1)检验这种新型洗涤剂中金属阳离子的操作和现象是
(2)这种洗涤剂中的双氧水可以将废水中的氰化物转化为无毒物同时生成NH3,写出反应的离子方程式
(3)如果配制洗涤剂的水中含有铁离子,不仅会削弱洗涤剂的去污能力,甚至完全失去杀菌作用.试分析其中的原因(用离子方程式和简要文字表述)
①
Fe3+与CO32-水解相互促进水解,使洗涤剂失去去污能力
Fe3+与CO32-水解相互促进水解,使洗涤剂失去去污能力
(4)某化学学习小组为了定性探究铁离子对这种新型洗涤剂的不良影响,取该洗涤剂100ml,加入25gFeCl3固体,产生大量无色无味气体,用贮气瓶收集气体.请选用下列试剂和实验用品完成气体成分的探究过程:0.10mol?L-1 NaOH、8.0mol?L-1 NaOH、澄清石灰水、0.01mol?L-1KMnO4、BaCl2稀溶液、品红溶液、蒸馏水、木条、酒精灯、火柴、洗气瓶.
①提出假设:对该气体成分提出合理假设.
假设1:气体是O2;
假设2:气体是
假设3:气体是CO2
②设计方案:设计实验方案证明你的假设,在答题卡上完成实验步骤、预期现象与结论:
| 实验步骤 | 预期现象与结论 |
| 将气体依次通入盛有澄清石灰水、 8.0mol?L-1 8.0mol?L-1 NaOH溶液 NaOH溶液 的洗气瓶中,并将带火星的木条放在最后一个洗气瓶的出口处 并将带火星的木条放在最后一个洗气瓶的出口处 . |
若澄清石灰水不变浑浊,木条复燃,则假设1成立; 若 澄清石灰水变浑浊,木条复燃 澄清石灰水变浑浊,木条复燃 ,则假设2成立;若澄清石灰水变浑浊,木条不复燃,则假设3成立. |
氨是一种重要的化工产品,是氮肥工业及制造硝酸的原料。为探究氨气的性质,某研究性学习小组做了以下实验:

⑴ 实验室用A图所示实验装置及化学药品(其中碱石灰为固体氢氧化钠和生石灰的混合物来制取氨气。
① 实验室制取氨气的化学方程式为 。
② 若用加热碳酸氢铵固体制取纯净的氨气,你认为装置中U型管的作用是
。
⑵ 在实验中发现E装置中的固体由黑色变为红色,可推测氨气具有 性。
⑶ 某同学查阅资料发现Cu2O粉末也呈红色,因此推测上述红色固体中可能还含有Cu2O。已知:① Cu2O是碱性氧化物,在酸性溶液中Cu+不稳定,易转化为Cu和Cu2+。
② 在空气中高温灼烧时:Cu2O稳定、不分解,而CuO将分解生成Cu2O和O2。
现有浓硝酸、稀硫酸、稀硝酸、氢氧化钠溶液及pH试纸,而没有其他试剂,请用最简便的实验方法证明红色固体中是否含有Cu2O。(简述操作方法、现象和结论)
![]() ⑷ 现有一份一定质量Cu和Cu2O混合物,向其中加入0.4L 3.0mol/L稀硝酸,混合物完全溶解,同时生成4.48L NO(标准状况),向所得溶液中加入一定体积1.0mol/L NaOH溶液恰好使Cu2+沉淀完全,沉淀经洗涤、充分灼烧可得32.0g固体。下列有关说法正确的是【已知:3Cu2O + 14HNO3(稀) 6Cu(NO3)2 + 2NO↑+ 7H2O】___________
⑷ 现有一份一定质量Cu和Cu2O混合物,向其中加入0.4L 3.0mol/L稀硝酸,混合物完全溶解,同时生成4.48L NO(标准状况),向所得溶液中加入一定体积1.0mol/L NaOH溶液恰好使Cu2+沉淀完全,沉淀经洗涤、充分灼烧可得32.0g固体。下列有关说法正确的是【已知:3Cu2O + 14HNO3(稀) 6Cu(NO3)2 + 2NO↑+ 7H2O】___________
A.加入NaOH溶液的体积为1.2L
B.Cu和Cu2O混合物质量为27.2g
C.混合物完全溶解后溶液中n(H+)=0.3mol
D.将等质量混合物完全还原至少需标准状况下H21.12L
查看习题详情和答案>>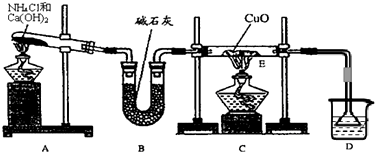
(1)实验室用A图所示实验装置及化学药品(其中碱石灰为固体氢氧化钠和生石灰的混合物来制取氨气.
①实验室制取氨气的化学方程式为
②若用加热碳酸氢铵固体制取纯净的氨气,你认为装置中U型管的作用是
(2)在实验中发现E装置中的固体由黑色变为红色,可推测氨气具有
(3)某同学查阅资料发现Cu2O粉末也呈红色,因此推测上述红色固体中可能还含有Cu2O.已知:①Cu2O是碱性氧化物,在酸性溶液中Cu+不稳定,易转化为Cu和Cu2+.
②在空气中高温灼烧时:Cu2O稳定、不分解,而CuO将分解生成Cu2O和O2.
现有浓硝酸、稀硫酸、稀硝酸、氢氧化钠溶液及pH试纸,而没有其他试剂,请用最简便的实验方法证明红色固体中是否含有Cu2O.(简述操作方法、现象和结论)
(4)现有一份一定质量Cu和Cu2O混合物,向其中加入0.4L 3.0mol/L稀硝酸,混合物完全溶解,同时生成4.48L NO(标准状况),向所得溶液中加入一定体积1.0mol/L NaOH溶液恰好使Cu2+沉淀完全,沉淀经洗涤、充分灼烧可得32.0g固体.下列有关说法正确的是【已知:3Cu2O+14HNO3(稀)═6Cu(NO3)2+2NO↑+7H2O】
A.加入NaOH溶液的体积为1.2L
B.Cu和Cu2O混合物质量为27.2g
C.混合物完全溶解后溶液中n(H+)=0.3mol
D.将等质量混合物完全还原至少需标准状况下H21.12L. 查看习题详情和答案>>
 某校化学课外小组为了鉴别碳酸钠和碳酸氢钠两种白色固体,用不同的方法做了以下实验,如图Ⅰ~Ⅳ所示.
某校化学课外小组为了鉴别碳酸钠和碳酸氢钠两种白色固体,用不同的方法做了以下实验,如图Ⅰ~Ⅳ所示.(1)只根据图Ⅰ、Ⅱ所示实验,能够达到实验目的是(填装置序号)
(2)图Ⅲ、Ⅳ所示实验均能鉴别这两种物质,其反应的化学方程式为
| ||
| ||
与实验Ⅲ相比,实验Ⅳ的优点是(填选项序号)
A.Ⅳ比Ⅲ复杂
B.Ⅳ比Ⅲ安全
C.Ⅳ比Ⅲ操作简便
D.Ⅳ可以做到用一套装置同时进行两个对比实验,而Ⅲ不行
(3)若用实验Ⅳ验证碳酸钠和碳酸氢钠的稳定性,则试管B中装入的固体最好是(填化学式)
(4)将碳酸氢钠溶液与澄清石灰水混合并充分反应,
①当石灰水过量时,其离子方程式为:
②当碳酸氢钠与氢氧化钙物质的量之比为2:1时,所得溶液中溶质的化学式为

(1)只根据图Ⅰ、Ⅱ所示实验,能够达到实验目的是(填装置序号)
(2)①图Ⅲ、Ⅳ所示实验均能鉴别这两种物质,其反应的化学方程式为
| ||
| ||
②与实验Ⅲ相比,实验Ⅳ的优点是(填选项序号)
A.Ⅳ比Ⅲ复杂 B.Ⅳ比Ⅲ安全 C.Ⅳ比Ⅲ操作简便
D.Ⅳ可以做到用一套装置同时进行两个对比实验,而Ⅲ不行
(3)若用实验Ⅳ验证碳酸钠和碳酸氢钠的稳定性,则试管B中装入的固体最好是(填化学式)
(4)将碳酸氢钠溶液与澄清石灰水混合并充分反应.当碳酸氢钠与氢氧化钙的物质的量之比为2:1时,所得溶液中溶质的化学式为
(5)请设计一个可鉴别碳酸钠和碳酸氢钠实验(写出实验原理).