题目内容
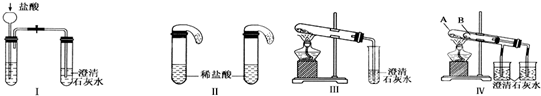
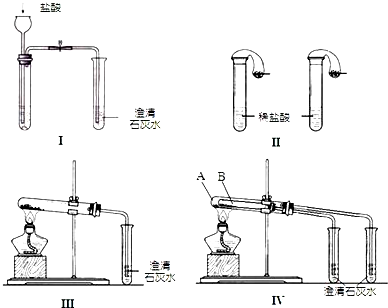
某校化学课外小组为了鉴别碳酸钠和碳酸氢钠两种白色固体,用不同的方法做了以下实验.如图I~Ⅳ所示.

(1)只根据图Ⅰ、Ⅱ所示实验,能够达到实验目的是(填装置序号)
(2)①图Ⅲ、Ⅳ所示实验均能鉴别这两种物质,其反应的化学方程式为
②与实验Ⅲ相比,实验Ⅳ的优点是(填选项序号)
A.Ⅳ比Ⅲ复杂 B.Ⅳ比Ⅲ安全 C.Ⅳ比Ⅲ操作简便
D.Ⅳ可以做到用一套装置同时进行两个对比实验,而Ⅲ不行
(3)若用实验Ⅳ验证碳酸钠和碳酸氢钠的稳定性,则试管B中装入的固体最好是(填化学式)
(4)将碳酸氢钠溶液与澄清石灰水混合并充分反应.当碳酸氢钠与氢氧化钙的物质的量之比为2:1时,所得溶液中溶质的化学式为
(5)请设计一个可鉴别碳酸钠和碳酸氢钠实验(写出实验原理).

(1)只根据图Ⅰ、Ⅱ所示实验,能够达到实验目的是(填装置序号)
Ⅱ
Ⅱ
;(2)①图Ⅲ、Ⅳ所示实验均能鉴别这两种物质,其反应的化学方程式为
2NaHCO3
Na2CO3+H2O+CO2↑;
| ||
2NaHCO3
Na2CO3+H2O+CO2↑;
;
| ||
②与实验Ⅲ相比,实验Ⅳ的优点是(填选项序号)
D
D
;A.Ⅳ比Ⅲ复杂 B.Ⅳ比Ⅲ安全 C.Ⅳ比Ⅲ操作简便
D.Ⅳ可以做到用一套装置同时进行两个对比实验,而Ⅲ不行
(3)若用实验Ⅳ验证碳酸钠和碳酸氢钠的稳定性,则试管B中装入的固体最好是(填化学式)
NaHCO3
NaHCO3
.(4)将碳酸氢钠溶液与澄清石灰水混合并充分反应.当碳酸氢钠与氢氧化钙的物质的量之比为2:1时,所得溶液中溶质的化学式为
Na2CO3
Na2CO3
,请设计实验检验所得溶液中溶质的阴离子取上层清液于洁净的试管中加入适量CaCl2溶液,振荡,若有白色沉淀生成,则证明溶液中含有CO32-
取上层清液于洁净的试管中加入适量CaCl2溶液,振荡,若有白色沉淀生成,则证明溶液中含有CO32-
.(5)请设计一个可鉴别碳酸钠和碳酸氢钠实验(写出实验原理).
分析:(1)根据实验现象是否有明显区别判断.
(2)①碳酸氢钠不稳定,在加热条件下能分解生成碳酸钠、二氧化碳和水,碳酸钠较稳定,加热不易分解.
②根据是否有对比性判断.
(3)不直接加热碳酸氢钠就能分解更说明碳酸氢钠不稳定.
(4)根据反应方程式判断溶液中的溶质;碳酸根离子能和钙离子反应生成碳酸钙白色沉淀,向上层清液中加入氯化钙溶液,若产生白色沉淀,就证明有碳酸根离子.
(5)根据碳酸钠和碳酸氢钠性质的不同设计实验.
(2)①碳酸氢钠不稳定,在加热条件下能分解生成碳酸钠、二氧化碳和水,碳酸钠较稳定,加热不易分解.
②根据是否有对比性判断.
(3)不直接加热碳酸氢钠就能分解更说明碳酸氢钠不稳定.
(4)根据反应方程式判断溶液中的溶质;碳酸根离子能和钙离子反应生成碳酸钙白色沉淀,向上层清液中加入氯化钙溶液,若产生白色沉淀,就证明有碳酸根离子.
(5)根据碳酸钠和碳酸氢钠性质的不同设计实验.
解答:解:(1)无论碳酸钠还是碳酸氢钠都能和盐酸反应生成二氧化碳,二氧化碳能使澄清的石灰水变浑浊,故Ⅰ无法鉴别;
实验Ⅱ中,盐酸和碳酸氢钠反应立即产生气泡,盐酸和碳酸钠先反应生成碳酸氢钠,碳酸氢钠和盐酸反应生成二氧化碳气体,所以看到的现象不同,故能鉴别碳酸钠和碳酸氢钠.
故答案为:Ⅱ.
(2)①碳酸氢钠在加热条件下能分解生成碳酸钠、水和二氧化碳2NaHCO3
Na2CO3+H2O+CO2↑.
②Ⅳ可以做到用一套装置同时进行两个对比实验,而Ⅲ不行,故选D.
故答案为:2NaHCO3
Na2CO3+H2O+CO2↑;D.
(3)碳酸钠直接加热,碳酸氢钠不直接加热,不直接加热的碳酸氢钠能分解而直接加热的碳酸钠不分解更能说明碳酸氢钠不稳定.
故答案为:NaHCO3.
(4)碳酸氢钠与氢氧化钙的物质的量之比为2:1时,反应方程式为
2NaHCO3+Ca(OH)2=CaCO3↓+Na2CO3+2H2O,根据方程式知该溶液是碳酸钠溶液;该溶液中含有碳酸根离子,碳酸根离子能和钙离子生成白色沉淀,所以检验方法是:取上层清液于洁净的试管中加入适量CaCl2溶液,振荡,若有白色沉淀生成,则证明溶液中含有CO32-.
故答案为:Na2CO3;取上层清液于洁净的试管中加入适量CaCl2溶液,振荡,若有白色沉淀生成,则证明溶液中含有CO32-.
(5)加热固体,能使澄清石灰水变浑浊固体是碳酸氢钠,不能使澄清石灰水变浑浊的是碳酸钠,2NaHCO3
Na2CO3+H2O+CO2↑.
故答案为:加热固体,能使澄清石灰水变浑浊固体是碳酸氢钠,不能使澄清石灰水变浑浊的是碳酸钠,
2NaHCO3
Na2CO3+H2O+CO2↑.
实验Ⅱ中,盐酸和碳酸氢钠反应立即产生气泡,盐酸和碳酸钠先反应生成碳酸氢钠,碳酸氢钠和盐酸反应生成二氧化碳气体,所以看到的现象不同,故能鉴别碳酸钠和碳酸氢钠.
故答案为:Ⅱ.
(2)①碳酸氢钠在加热条件下能分解生成碳酸钠、水和二氧化碳2NaHCO3
| ||
②Ⅳ可以做到用一套装置同时进行两个对比实验,而Ⅲ不行,故选D.
故答案为:2NaHCO3
| ||
(3)碳酸钠直接加热,碳酸氢钠不直接加热,不直接加热的碳酸氢钠能分解而直接加热的碳酸钠不分解更能说明碳酸氢钠不稳定.
故答案为:NaHCO3.
(4)碳酸氢钠与氢氧化钙的物质的量之比为2:1时,反应方程式为
2NaHCO3+Ca(OH)2=CaCO3↓+Na2CO3+2H2O,根据方程式知该溶液是碳酸钠溶液;该溶液中含有碳酸根离子,碳酸根离子能和钙离子生成白色沉淀,所以检验方法是:取上层清液于洁净的试管中加入适量CaCl2溶液,振荡,若有白色沉淀生成,则证明溶液中含有CO32-.
故答案为:Na2CO3;取上层清液于洁净的试管中加入适量CaCl2溶液,振荡,若有白色沉淀生成,则证明溶液中含有CO32-.
(5)加热固体,能使澄清石灰水变浑浊固体是碳酸氢钠,不能使澄清石灰水变浑浊的是碳酸钠,2NaHCO3
| ||
故答案为:加热固体,能使澄清石灰水变浑浊固体是碳酸氢钠,不能使澄清石灰水变浑浊的是碳酸钠,
2NaHCO3
| ||
点评:本题考查了碳酸钠和碳酸氢钠的性质,难度较大的是实验设计,要根据物质的性质来设计实验,检验物质的性质.

练习册系列答案
相关题目
 某校化学课外小组为了鉴别碳酸钠和碳酸氢钠两种白色固体,用不同的方法做了以下实验,如图Ⅰ~Ⅳ所示.
某校化学课外小组为了鉴别碳酸钠和碳酸氢钠两种白色固体,用不同的方法做了以下实验,如图Ⅰ~Ⅳ所示.