摘要:下图每一方框中的字母代表一种反应物或生成物: 物质A跟B反应生成物质E.F和G,物质C跟D反应生成物质I.某温度下该反应起始和某时刻的反应混合物组成如右上表格所示.请填写下列空白: (1) 物质H的分子式是 . (2) 反应①的化学方程式是 . 反应②的化学方程式是 . (1)HCl (2)Cl2+2NaOH?NaCl+NaClO+H2O (3) N2+3H2 2NH3(化学方程式3分.反应条件2分)
网址:http://m.1010jiajiao.com/timu3_id_348768[举报]
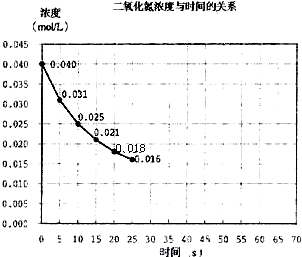 (2000?上海)二氧化氮在加热条件下能够分解成一氧化氮和氧气.该反应进行到45秒时,达到平衡(NO2浓度约为0.0125mol/L).图中的曲线表示二氧化氮分解反应在前25秒内的反应进程.
(2000?上海)二氧化氮在加热条件下能够分解成一氧化氮和氧气.该反应进行到45秒时,达到平衡(NO2浓度约为0.0125mol/L).图中的曲线表示二氧化氮分解反应在前25秒内的反应进程.(1)请计算前20秒内氧气的平均生成速率:
(2)若反应延续至70秒,请在图中用实线画出25秒至70秒的反应进程曲线.
(3)若在反应开始时加入催化剂(其他条件都不变),请在图上用虚线画出加催化剂后的反应进程曲线.
(4)写出该反应的化学平衡常数表达式:
| c2(NO)?c(O2) |
| c2(NO2) |
| c2(NO)?c(O2) |
| c2(NO2) |
(2011?江西)氮化硼(BN)是一种重要的功能陶瓷材料.以天然硼砂为起始物,经过一系列反应可以得到BF3和BN,如下图所示
请回答下列问题:
(1)由B2O3制备BF3、BN的化学方程式依次是
(2)基态B原子的电子排布式为
(3)在BF3分子中,F-B-F的键角是
(4)在与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间的化学键为
(5)六方氮化硼在高温高压下,可以转化为立方氮化硼,其结构与金刚石相似,硬度与金刚石相当,晶胞边长为361.5pm,立方氮化硼晶胞中含有
g?cm-3(只要求列算式,不必计算出数值,阿伏伽德罗常数为NA).
查看习题详情和答案>>

请回答下列问题:
(1)由B2O3制备BF3、BN的化学方程式依次是
B2O3+3CaF2+3H2SO4
2BF3↑+3CaSO4+3H2O
| ||
B2O3+3CaF2+3H2SO4
2BF3↑+3CaSO4+3H2O
、
| ||
B2O3+2NH3
2BN+3H2O
| ||
B2O3+2NH3
2BN+3H2O
;
| ||
(2)基态B原子的电子排布式为
1s22s22p1
1s22s22p1
;B和N相比,电负性较大的是N
N
,BN中B元素的化合价为+3
+3
;(3)在BF3分子中,F-B-F的键角是
120°
120°
,B原子的杂化轨道类型为sp2
sp2
,BF3和过量NaF作用可生成NaBF4,BF4-的立体结构为正四面体
正四面体
;(4)在与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间的化学键为
共价键(或极性共价键)
共价键(或极性共价键)
,层间作用力为分子间作用力
分子间作用力
;(5)六方氮化硼在高温高压下,可以转化为立方氮化硼,其结构与金刚石相似,硬度与金刚石相当,晶胞边长为361.5pm,立方氮化硼晶胞中含有
4
4
个氮原子、4
4
个硼原子,立方氮化硼的密度是| 25×4 |
| (361.5×10-101×)3NA |
| 25×4 |
| (361.5×10-101×)3NA |
大气固氮和合成氮是周氮的重要形式.下表是大气固氮和合成氨的部分K值:
(1)大气固氮是 (“吸热”、“放热”)反应;人工固氮对农业意义十分重大,根据表中数据,可推知合成氨最重要的研究方向是 .
(2)工业合成氨原料气的制备主要方法如下:
(1)以空气为原料制备N2,其方法是 .
(2)以焦炭和水为原料制备H2,反应原理为 、 .
H2中混有的CO可用醋酸亚铜氨溶液吸收,以防止合成氨时催化剂中毒:CO(g)+Cu(NH3)2Ac(aq)═Cu(NH3)2AC?CO(aq)+Q(Q>0);要从除杂后的溶液中“再生”出醋酸亚铜氨,可 (“升”“降”)温、 (“增”“降”)压.
(3)液氨和水类似,也能自离解(电离):NH3+NH3═NH4++NH2-.
①液氨的离子积可以表示为 .
②25℃时,液氨的离子积K=1.0×10-30.若将NaNH2固体加入液氨中,则所得溶液中不存在的关系式是(设温度保持不变) (选填编号)
a.c(Na+)=c(NH2-) b.c(NH4+)?c(NH2-)=1.0×10-30 c.c(NH2-)>c(NH4+)
(4)若在液氨中NaNH2和NH4Cl都能完全电离,则用标准NaNH2液氨溶液滴定未知浓度NH4Cl液氨溶液时,反应的离子方程式为 .
查看习题详情和答案>>
| N2+O2═2NO | N2+3H2═2NH3 | |||
| 温度 | 25℃ | 2000℃ | 25℃ | 400℃ |
| 平衡常数K | 3.84×10-31 | 0.1 | 5×108 | 200 |
(2)工业合成氨原料气的制备主要方法如下:
(1)以空气为原料制备N2,其方法是
(2)以焦炭和水为原料制备H2,反应原理为
H2中混有的CO可用醋酸亚铜氨溶液吸收,以防止合成氨时催化剂中毒:CO(g)+Cu(NH3)2Ac(aq)═Cu(NH3)2AC?CO(aq)+Q(Q>0);要从除杂后的溶液中“再生”出醋酸亚铜氨,可
(3)液氨和水类似,也能自离解(电离):NH3+NH3═NH4++NH2-.
①液氨的离子积可以表示为
②25℃时,液氨的离子积K=1.0×10-30.若将NaNH2固体加入液氨中,则所得溶液中不存在的关系式是(设温度保持不变)
a.c(Na+)=c(NH2-) b.c(NH4+)?c(NH2-)=1.0×10-30 c.c(NH2-)>c(NH4+)
(4)若在液氨中NaNH2和NH4Cl都能完全电离,则用标准NaNH2液氨溶液滴定未知浓度NH4Cl液氨溶液时,反应的离子方程式为
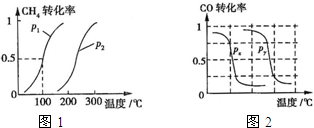 (2013?江西模拟)甲醇是一种很好的燃料,工业上用CH4和H2O为原料,通过下述反应Ⅰ和Ⅱ来制备甲醇.
(2013?江西模拟)甲醇是一种很好的燃料,工业上用CH4和H2O为原料,通过下述反应Ⅰ和Ⅱ来制备甲醇.(1)将1.0mol CH4和2.0mol H2O(g)通入反应室(容积为100L),在一定条件下发生反应:CH4(g)+H2O(g)?CO(g)+3H2(g)…I.CH4的转化率与温度、压强的关系如图.
①已知100℃时达到平衡所需的时间为5min,则用H2表示的平均反应速率为
0.003mol/(L?min)
0.003mol/(L?min)
.②图中的P1
<
<
P2(填“<”、“>”或“=”),100℃时平衡常数为2.25×10-4
2.25×10-4
.③该反应的△H
>
>
0(填“<”、“>”或“=”).(2)在压强为0.1MPa条件下,将a mol CO与3amol H2的混合气体在催化剂作用下能自发反应生成甲醇:CO(g)+2H2(g)?CH3OH(g)△H<0
Ⅱ.
①若容器容积不变,下列措施可增加甲醇产率的是
BD
BD
.A.升高温度 B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大 D.再充入1mol CO和3mol H2
②为了寻找合成甲醇的温度和压强的适宜条件,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中.
| 实验编号 | T(℃) | n(CO)/n(H2) | p(MPa) | ||
| l | 150 |
|
0.1 | ||
| 2 | n |
|
5 | ||
| 3 | 350 | m | 5 |
150
150
、b=| 1 |
| 3 |
| 1 |
| 3 |
B.根据反应Ⅱ的特点,右上图是在压强分别为0.1MPa和5MPa下CO的转化率随温度变化的曲线图,请指明图中的压强Px=
0.1
0.1
MPa.