摘要: 某学生有0.10mol/L KOH溶液滴定未知浓度的盐酸溶液.其操作可分解为如下几步: (A)取标准KOH溶液注入碱式滴定管至0刻度以上2-3cm (B)用标准溶液润洗滴定管2-3次 (C)把盛有标准溶液的碱式滴定管固定好.调节液面使滴定管尖嘴充满溶液 (D)移取20.00mL待测的盐酸溶液注入洁净的锥形瓶.并加入2-3滴酚酞 (E)把锥形瓶放在滴定管的下面.用标准KOH溶液滴定至终点.并记下滴定管液面的刻度 (F)调节液面至0或0刻度以下.记下读数 完成以下填空: (1)正确操作的顺序是 . 操作的目的是 . 操作之前.如先用待测液润洗锥形瓶.则对测定结果的影响是(填偏大.偏小.不变.下同) . (4)实验中用左手控制 .眼睛注视 .直至滴定终点.判断到达终点的现象是 . (5)若称取一定量的KOH固体配制标准溶液并有来滴定上述盐酸.则对测定结果的影响是 -. (6)滴定结束后如俯视观察滴定管中液面刻度.则对滴定结果的影响是
网址:http://m.1010jiajiao.com/timu3_id_34858[举报]
某学生有0.1000mol/L KOH溶液滴定未知尝试的盐酸溶液,其操作可分解为如下几步:
(A)移取20.00mL待测的盐酸溶液注入洁净的锥形瓶,并加入2-3滴酚酞
(B)用标准溶液润洗滴定管2-3次
(C)把盛有标准溶液的碱式滴定管固定好,调节液面使滴定管尖嘴充满溶液
(D)取标准KOH溶液注入碱式滴定管至0刻度以上2-3cm
(E)调节液面至0或0刻度以下,记下读数
(F)把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点,记下滴定管液面的刻度
完成以下填空:
(1)正确操作的顺序是(用序号字母填写)______________________.
(2)上述(B)操作的目的是___________________________________。
(3)上述(A)操作之前,如先用待测液润洗锥形瓶,则对测定结果的影响是(填偏大、偏小、不变,下同)_________________________。
(4)实验中用左手控制____________(填仪器及部位),眼睛注视____________________,直至滴定终点。判断到达终点的现象是________________________________________。
(5)若称取一定量的KOH固体(含少量NaOH)配制标准溶液并有来滴定上述盐酸,则对测定结果的影响是___________________________________________________-。
(6)滴定结束后如仰视观察滴定管中液面刻度,则对滴定结果的影响是______________。
查看习题详情和答案>>
某学生用0.1mol?L-1的KOH标准溶液滴定未知浓度的盐酸,其操作分解为如下几步:
A.移取20mL待测盐酸注入洁净的锥形瓶,并加入2~3滴酚酞
B.用标准溶液润洗滴定管2~3次
C.把盛有标准溶液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液
D.取标准KOH溶液注入碱式滴定管至“0”刻度以上1~2cm
E.调节液面至“0”或“0”以下刻度,记下读数
F.在锥形瓶下垫一张白纸,把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点并记下滴定管液面的刻度.
就此实验完成填空:
(1)正确操作步骤的顺序是(用序号字母填写) ;
(2)操作中锥形瓶下垫一张白纸的作用是 ;
(3)判断到达滴定终点的实验现象是 _.
查看习题详情和答案>>
A.移取20mL待测盐酸注入洁净的锥形瓶,并加入2~3滴酚酞
B.用标准溶液润洗滴定管2~3次
C.把盛有标准溶液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液
D.取标准KOH溶液注入碱式滴定管至“0”刻度以上1~2cm
E.调节液面至“0”或“0”以下刻度,记下读数
F.在锥形瓶下垫一张白纸,把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点并记下滴定管液面的刻度.
就此实验完成填空:
(1)正确操作步骤的顺序是(用序号字母填写)
(2)操作中锥形瓶下垫一张白纸的作用是
(3)判断到达滴定终点的实验现象是
某学生用0.2000mol?L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作如下:
①用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上;
②固定好滴定管并使滴定管尖嘴充满液体;
③调节液面至“0”或“0”刻度线稍下,并记下读数;
④移取20.00mL待测液注入洁净的还存有少量蒸馏水的锥形瓶中,并加入3滴酚酞试液;
⑤用标准液滴定至终点,记下滴定管液面读数.
请回答:
(1)以上步骤有错误的是(填编号)
A.配制标准溶液的固体NaOH中混有KOH杂质
B.滴定终点读数时,仰视滴定管的刻度,其他操作正确
C.盛装未知液的锥形瓶用蒸馏水洗过后再用未知液润洗
D.滴定到终点读数时,发现滴定管尖嘴处悬挂一滴溶液
(2)判断滴定终点的现象是:
(3)如图1是某次滴定时的滴定管中的液面,其读数为

(4)排去碱式滴定管中气泡的方法应采用图2中的
(5)根据下列数据:请计算待测盐酸溶液的浓度:
查看习题详情和答案>>
①用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上;
②固定好滴定管并使滴定管尖嘴充满液体;
③调节液面至“0”或“0”刻度线稍下,并记下读数;
④移取20.00mL待测液注入洁净的还存有少量蒸馏水的锥形瓶中,并加入3滴酚酞试液;
⑤用标准液滴定至终点,记下滴定管液面读数.
请回答:
(1)以上步骤有错误的是(填编号)
①
①
,若测定结果偏高,其原因可能是AD
AD
.A.配制标准溶液的固体NaOH中混有KOH杂质
B.滴定终点读数时,仰视滴定管的刻度,其他操作正确
C.盛装未知液的锥形瓶用蒸馏水洗过后再用未知液润洗
D.滴定到终点读数时,发现滴定管尖嘴处悬挂一滴溶液
(2)判断滴定终点的现象是:
锥形瓶中溶液由无色变为浅红色,半分钟不褪色;
锥形瓶中溶液由无色变为浅红色,半分钟不褪色;
.(3)如图1是某次滴定时的滴定管中的液面,其读数为
22.60
22.60
mL.
(4)排去碱式滴定管中气泡的方法应采用图2中的
丙
丙
操作,然后轻轻挤压玻璃球使尖嘴部分充满碱液.(5)根据下列数据:请计算待测盐酸溶液的浓度:
0.2000
0.2000
mol/L.| 滴定次数 | 待测体积(mL) | 标准烧碱体积(mL) | |
| 滴定前读数 | 滴定后读数 | ||
| 第一次 | 20.00 | 0.40 | 20.40 |
| 第二次 | 20.00 | 2.00 | 21.80 |
| 第三次 | 20.00 | 4.00 | 24.20 |
某学生用0.1mol/L KOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:
①移取20.00mL待测的盐酸溶液注入洁净的锥形瓶,并加入2-3滴酚酞
②用标准溶液润洗滴定管2-3次
③把盛有标准溶液的碱式滴定管固定好,调节液面使滴定管尖嘴充满溶液
④取标准KOH溶液注入碱式滴定管至0刻度以上2-3cm
⑤调节液面至0或0刻度以下,记下读数
⑥把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点,记下滴定管液面的刻度
完成以下填空:
(1)正确操作的顺序是(用序号填写)
(2)上述②操作的目的是
(3)实验中用左手控制
下列操作,对测定结果的影响是(填“偏大”、“偏小”、“不变”)
(4)上述①操作之前,如先用蒸馏水洗锥形瓶
(5)滴定结束后如仰视观察滴定管中液面刻度
(6)若称取一定量的KOH固体(含少量NaOH)配制标准溶液并用来滴定上述盐酸,则
查看习题详情和答案>>
①移取20.00mL待测的盐酸溶液注入洁净的锥形瓶,并加入2-3滴酚酞
②用标准溶液润洗滴定管2-3次
③把盛有标准溶液的碱式滴定管固定好,调节液面使滴定管尖嘴充满溶液
④取标准KOH溶液注入碱式滴定管至0刻度以上2-3cm
⑤调节液面至0或0刻度以下,记下读数
⑥把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点,记下滴定管液面的刻度
完成以下填空:
(1)正确操作的顺序是(用序号填写)
②④③⑤①⑥
②④③⑤①⑥
(2)上述②操作的目的是
防止将标准液稀释
防止将标准液稀释
(3)实验中用左手控制
碱式滴定管橡皮管玻璃珠处
碱式滴定管橡皮管玻璃珠处
(填仪器及部位),眼睛注视锥形瓶中溶液的颜色变化
锥形瓶中溶液的颜色变化
,直至滴定终点.判断到达终点的现象是锥形瓶中溶液的颜色由无色变浅红且保持30秒内不褪色
锥形瓶中溶液的颜色由无色变浅红且保持30秒内不褪色
.下列操作,对测定结果的影响是(填“偏大”、“偏小”、“不变”)
(4)上述①操作之前,如先用蒸馏水洗锥形瓶
不变
不变
.(5)滴定结束后如仰视观察滴定管中液面刻度
偏大
偏大
(6)若称取一定量的KOH固体(含少量NaOH)配制标准溶液并用来滴定上述盐酸,则
偏小
偏小
.某学生用0.2000mol?L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作可分为如下几步:
①用蒸馏水洗涤碱式滴定管后立即注入NaOH溶液至“0”刻度线以上;
②固定好滴定管并使滴定管尖嘴充满液体;
③调节液面至“0”或“0”刻度线稍下,并记下读数;
④量取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液;
⑤用标准液滴定至终点,记下滴定管液面读数.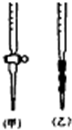
请回答:
(1)以上操作步骤中有一步有错误,请指出编号
(2)用标准NaOH溶液滴定时,应将标准NaOH溶液注入
(3)下列操作会引起实验结果偏大的是:
A.在锥形瓶装液前,留有少量蒸馏水
B.滴定前,碱式滴定管尖嘴有气泡,滴定后无气泡
C.锥形瓶先用蒸馏水洗涤后,再用待测液润洗
D.用酸式滴定管量取待测液时将一滴待测液滴在锥形瓶外
(4)判断到达滴定终点的现象是:锥形瓶中溶液从
(5)以下是实验数据记录表
通过计算可得,该盐酸浓度为:
查看习题详情和答案>>
①用蒸馏水洗涤碱式滴定管后立即注入NaOH溶液至“0”刻度线以上;
②固定好滴定管并使滴定管尖嘴充满液体;
③调节液面至“0”或“0”刻度线稍下,并记下读数;
④量取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液;
⑤用标准液滴定至终点,记下滴定管液面读数.

请回答:
(1)以上操作步骤中有一步有错误,请指出编号
①
①
,该错误操作会导致测定结果偏大
偏大
(填“偏大”、“偏小”或“无影响”)(2)用标准NaOH溶液滴定时,应将标准NaOH溶液注入
乙
乙
中.(从图中选填“甲”或“乙”)(3)下列操作会引起实验结果偏大的是:
BC
BC
(填编号)A.在锥形瓶装液前,留有少量蒸馏水
B.滴定前,碱式滴定管尖嘴有气泡,滴定后无气泡
C.锥形瓶先用蒸馏水洗涤后,再用待测液润洗
D.用酸式滴定管量取待测液时将一滴待测液滴在锥形瓶外
(4)判断到达滴定终点的现象是:锥形瓶中溶液从
无色
无色
色变为浅红
浅红
色,且半分钟之内不再改变.(5)以下是实验数据记录表
| 滴定次数 | 盐酸体积mL | NaOH溶液体积读数(mL) | |
| 滴定前 | 滴定后 | ||
| 1 | 20.00 | 0.00 | 16.30 |
| 2 | 20.00 | 0.00 | 16.22 |
0.1626
0.1626
mol?L-1(计算结果保留4位小数).