摘要:15.向100mL NaOH溶液中通人标准状况下的C01.12 L后.将溶液小心蒸干得到不含结晶水的固体5.08g.则下列说法中.正确的是 ( ) A.原NaOH溶液的浓度是1.00 mol·L.所得固体是NaC0 B.原NaOH溶液的浓度是O.500 mol·L.所得固体是NaC0和NaHC0 C.原NaOH溶液的浓度是1.00 mol·L.所得固体是NaOH和NaC0 D.原NaOH溶液的浓度是0.900 mol·L.所得固体是NaC0和NaHC0
网址:http://m.1010jiajiao.com/timu3_id_347586[举报]
在给定条件下,下列加点的物质在化学反应中能被“全消耗”的是( )
A、用50mL 12 mol?L-1
| ||||
B、标准状况下,将1g
| ||||
C、向100mL 3 mol?L-1的硝酸中加入5.6g
| ||||
D、在5×107Pa、500℃和铁触媒催化的条件下,用2mol氮气和3mol
|
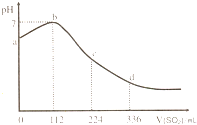 标准状况下,某同学向 100mL H2S 饱和溶液中通入SO2,所得溶液pH变化如图所示.下列分析中,正确的是( )
标准状况下,某同学向 100mL H2S 饱和溶液中通入SO2,所得溶液pH变化如图所示.下列分析中,正确的是( )| A、ab 段的反应是:SO2+2H2S=3S↓+2 H2O | B、b 点对应的溶液导电性最强 | C、原H2S溶液的物质的量浓度为0.1mol?L-1 | D、bd段对应的溶液呈酸性的原因是:H2SO3=2H++SO32- |
(1)写出工业用纯碱、石灰石、石英制普通玻璃的化学方程式 .
(2)生成白色Fe(OH)2沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液.原因是 (用化学方程式表式).
(3)向100mL水中投入Na和Al共16克,充分反应后分析剩余金属1g.计算放出H2的体积为 升(标准状况下)
(4)向含有0.3mol的NaAlO2溶液中滴加1mol/L HCl,当生成7.8克沉淀时,加入盐酸的体积为 mL.
(5)向一定量的Fe、Fe2O3和CuO混合物投入120mL 2.2mol/L的硫酸溶液中,充分反应后生成896mL标准状况下的气体,得不溶物1.28g,过滤后,向滤液中加入2mol/L的NaOH溶液,加至40mL时开始出现沉淀,则滤液中FeSO4的物质的量浓度为 (设滤液体积为120mL)mol/L.
查看习题详情和答案>>
(2)生成白色Fe(OH)2沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液.原因是
(3)向100mL水中投入Na和Al共16克,充分反应后分析剩余金属1g.计算放出H2的体积为
(4)向含有0.3mol的NaAlO2溶液中滴加1mol/L HCl,当生成7.8克沉淀时,加入盐酸的体积为
(5)向一定量的Fe、Fe2O3和CuO混合物投入120mL 2.2mol/L的硫酸溶液中,充分反应后生成896mL标准状况下的气体,得不溶物1.28g,过滤后,向滤液中加入2mol/L的NaOH溶液,加至40mL时开始出现沉淀,则滤液中FeSO4的物质的量浓度为
 (2010?金华模拟)已知Ba(AlO2)2可溶于水.如右下图是向100mL 0.02mol?L-1KAl(SO4)2溶液中逐滴加入0.05mol?L-1Ba(OH)2溶液时(25℃),生成沉淀的物质的量与加入Ba(OH)2溶液的体积的关系.下列说法不正确的是( )
(2010?金华模拟)已知Ba(AlO2)2可溶于水.如右下图是向100mL 0.02mol?L-1KAl(SO4)2溶液中逐滴加入0.05mol?L-1Ba(OH)2溶液时(25℃),生成沉淀的物质的量与加入Ba(OH)2溶液的体积的关系.下列说法不正确的是( )