网址:http://m.1010jiajiao.com/timu3_id_347331[举报]
(1)HmD的电子式:


(2)能证明Cm-、E(m-1)-还原性强弱的反应的离子方程式为
(3)用化学用语表示B的最高正价氧化物对应的水化物在水溶液中的电离过程
(4)已知17g HmC在一定条件下完全燃烧生成稳定化合物时放出热量为a kJ,写出能表示该物质燃烧热的热化学方程式
(5)常温下,将等物质的量浓度的HmC溶液和A的最高价氧化物对应的水化物溶液等体积混合,所得溶液显碱性,溶液中离子浓度由大到小的顺序为
(1)B与D形成化合物BD2的结构式为
(2)A、C、D三元素能形成一种强酸甲,写出单质B与甲的浓溶液反应的化学反应方程式
| ||
| ||
(3)均由A、D、E、F四种元素组成的两种盐,其相对分子质量相差16,写出它们在溶液中相互作用的离子方程式为
 HCO3-+OH-
HCO3-+OH- HCO3-+OH-
HCO3-+OH-(4)C2A4─空气燃料电池是一种碱性燃料电池.电解质溶液是20%~30%的KOH溶液.则燃料电池放电时:正极的电极反应式是
(5)已知:2CD2(g)
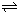 C2D4(g);△H<0.在恒温恒容条件下,将一定量CD2和C2D4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如图所示.
C2D4(g);△H<0.在恒温恒容条件下,将一定量CD2和C2D4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如图所示.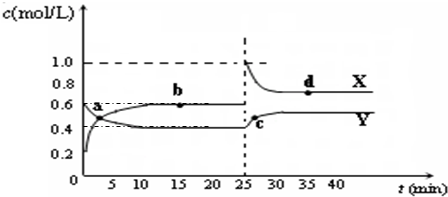
①a、b、c、d四个点中,化学反应处于平衡状态的是
②25min时,增加了
③a、b、c、d四个点所表示的反应体系中,气体颜色由深到浅的顺序是
(1)写出A与C形成化合物的电子式


(2)Cm-、E(m-1)-的还原性强弱为
(3)写出B的最高价氧化物对应的水化物和A的最高价氧化物对应的水化物反应的离子方程式
(4)元素B形成的单质与Fe3O4反应的化学方程式是
| ||
| ||
(5)上述五种元素,由其中三种元素组成的易溶于水的物质中,能促进水电离的物质是:
 HSO3-+OH-
HSO3-+OH- HSO3-+OH-
HSO3-+OH-A、B、C、D是短周期元素形成的四种气体单质,其它物质为化合物。H常作为普通锌锰干电池的电解质。有关的转化关系如下图所示(反应条件均已略去)。
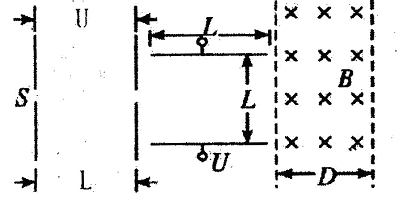
请回答下列问题:
(1)B的结构式为____ ,G的化学式为 。
(2)Y和E在一定条件下可反应生成B和Z,该反应的化学方程式为 。
(3)在体积为0.5L的恒容密闭容器中,充人1.25molB和1.25molD进行如下化学反应:
B(g)+3D(g)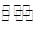 2Y(g),其化学平衡常数K与T的关系如下表所示:
2Y(g),其化学平衡常数K与T的关系如下表所示:
|
T/℃ |
300 |
400 |
|
K |
3.41 |
0.50 |
①若反应在400℃下进行,下列各项中能作为判断该反应达到化学平衡状态依据的是
(填字母)。
A.Y、B、D的物质的量分别为0.50mol、l.0mol、0.50mol
B.v正(B)= 3v 逆(D)
C.容器内压强保持不变
D.混合气体的密度保持不变
②在一定条件下B(g)+3D(g)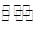 2Y(g)达到平衡状态,时间为t1时改变条件。化学反应速率与反应时间的关系如图。下列说法中正确的是( )
2Y(g)达到平衡状态,时间为t1时改变条件。化学反应速率与反应时间的关系如图。下列说法中正确的是( )
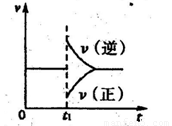
A.维持温度、反应体系体积不变,t1时充入Y(g)
B.维持压强不变,tl时升高反应体系温度
C.维持温度不变,t1时扩大反应体系体积
D.维持温度、压强不变,t1时充入Y(g)
(4)0.lmol·L-1的X溶液和0.2mol·L-1的Y溶液等体积混合后显碱性,则该混合溶液中各离子浓度大小顺序是 .
(5)常温下,0.1mol·L-1的Y溶液中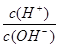 =l×10-8,下列叙述中错误的是 ( )
=l×10-8,下列叙述中错误的是 ( )
A.该溶液的pH=11
B.该溶液中的溶质电离出的阳离子浓度为0.1mol·L-1
C.该溶液中水电离出的c(H+)与c(OH—)乘积为l×10-22
D.pH=l的X溶液V1L与0.1mol·L-1的Y溶液V2L混合,若混合溶液pH =7,则V1<V2
E.将0.1mol·L-1的Y溶液加水稀释100倍后,pH >9
查看习题详情和答案>>