摘要:2.根据2KMnO4+10FeSO4+8H2SO4 = 2MnSO4+5Fe2(SO4)3+ K2SO4+8H2O的反应.在实验室里可 以选用与酸碱中和滴定相同的仪器和操作方法.测定绿矾中FeSO4 的百分含量.实验步 骤顺序如下: ① 称取绿矾样品W克.配成100 毫升溶液. ② 取25.0 毫升待测液.置于锥形瓶中.再加入适量H2SO4溶液供滴定使用. ③ 将m 摩/升的标准KMnO4溶液装入滴定管.调节液面该度至a毫升处. ④ 用标准KMnO4 溶液滴定待测液. ⑤ 该实验是用反应物自身颜色变化指示反应终点.到滴定终点时.滴定管内液面的高度为 6毫升. ⑥ 重复滴定操作2-3次. ⑦ 计算. 请根据以上实验步骤填写有关内容. 中.应从下列仪器中选取的是 A. 托盘天平 B. 50毫升酸式滴定管 C. 100毫升量筒 D. 100毫升容量瓶 E. 烧杯 F. 胶头滴管 G. 锥形瓶 H. 玻棒 I. V形纸槽 J. 药匙 B.D.F.H.J A.D.F.G.H 式滴定管盛放KMnO4 溶液. 请判断: (3) 锥形瓶用蒸馏水洗净的标志是(瓶内壁不挂水珠.不成股流下). 请判断: 若锥形瓶未干燥.对实验结果 (填1---“偏高 .2---“偏低 .3---“无影响 ) (4) 滴定时.两眼应注视锥形瓶的溶液颜色的变化,达到滴定终点的标志是 (KMnO4 溶液滴入后不再褪色). 请判断:
网址:http://m.1010jiajiao.com/timu3_id_34667[举报]
根据2KMnO4+5H2O2+3H2SO4→2MnSO4+K2SO4+8H2O+5O2↑,可以判断:
A.氧化性:H2O2 > KMnO4 B.还原性:KMnO4 > O2
C.氧化性:KMnO4 > O2 D.还原性:H2SO4 > K2SO4
查看习题详情和答案>>
某研究性学习小组为研究氯气是否具有漂白性,设计如下实验装置.试根据实验装置回答下列问题:
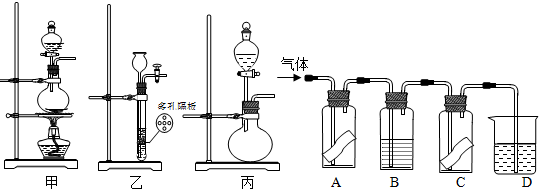
A、C中为干燥的有色布条,B为无色液体,D中为NaOH溶液
(1)在常温下,KMnO4固体可以与浓盐酸反应生成氯气,其反应方程式为:
2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O,则其反应装置应选用甲、乙、丙中的 .
(2)B中的液体为 ,其作用为 .
(3)A、C中有色布条的颜色变化分别为 ,A、C的实 验现象说明氯气是否具有漂白性? (填“是”或“否”).
(4)D中NaOH溶液的作用 (用离子方程式说明).
(5)将产生的氯气通入滴有酚酞的NaOH溶液中,溶液红色褪去.组内有甲、乙两种 意见:
甲:氯气溶于水溶液显酸性,中和了NaOH,使溶液褪为无色;
乙:氯气溶于水生成漂白性物质,使溶液褪为无色.
丙同学在褪色后的溶液中逐渐加入足量的NaOH溶液,溶液一直未见红色,则 的意见正确.(填“甲”或“乙”)
查看习题详情和答案>>

A、C中为干燥的有色布条,B为无色液体,D中为NaOH溶液
(1)在常温下,KMnO4固体可以与浓盐酸反应生成氯气,其反应方程式为:
2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O,则其反应装置应选用甲、乙、丙中的
(2)B中的液体为
(3)A、C中有色布条的颜色变化分别为
(4)D中NaOH溶液的作用
(5)将产生的氯气通入滴有酚酞的NaOH溶液中,溶液红色褪去.组内有甲、乙两种 意见:
甲:氯气溶于水溶液显酸性,中和了NaOH,使溶液褪为无色;
乙:氯气溶于水生成漂白性物质,使溶液褪为无色.
丙同学在褪色后的溶液中逐渐加入足量的NaOH溶液,溶液一直未见红色,则
影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究.
实验一:他们利用Cu、Fe、Mg和不同浓度的硫酸(0.5mol/L、2mol/L、18.4mol/L),设计实验方案来研究影响反应速率的因素.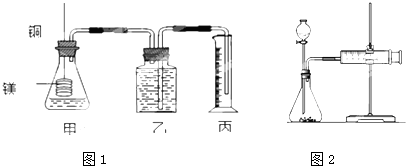
(1)甲同学研究的实验报告如下表:
该同学的实验目的是研究
(2)乙同学为了更精确地研究浓度对反应速率的影响,利用如图1装置进行定量实验.完成该实验应选用的实验药品是Mg(或Fe)和
实验二:已知2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2↑,在酸性高锰酸钾溶液和草酸溶液反应时,发现开始一段时间,反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快.
(3)针对上述实验现象,某同学认为KMnO4与H2C2O4反应是放热反应,导致溶液温度升高,反应速率加快.从影响化学反应速率的因素看,你的猜想还可能是
(4)若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液试剂外,还需要选择的试剂最合理的是
A、硫酸钾 B、硫酸锰 C、水 D、氯化锰.
查看习题详情和答案>>
实验一:他们利用Cu、Fe、Mg和不同浓度的硫酸(0.5mol/L、2mol/L、18.4mol/L),设计实验方案来研究影响反应速率的因素.

(1)甲同学研究的实验报告如下表:
| 实 验 步 骤 | 现 象 | 结 论 |
| ①分别取等体积的2mol/L硫酸于试管中; ②分别投入大小、形状相同的Cu、Fe、Mg. |
反应快慢: Mg>Fe>Cu |
反应物的性质越活泼,反应速率越快. |
反应物本身的性质
反应物本身的性质
对反应速率的影响;根据控制变量法,要得出正确的实验结论,还需控制的实验条件是保持温度
温度
相同.(2)乙同学为了更精确地研究浓度对反应速率的影响,利用如图1装置进行定量实验.完成该实验应选用的实验药品是Mg(或Fe)和
0.5mol/L、2mol/L
0.5mol/L、2mol/L
(从给出的药品去选);应该测定的实验数据是测定一定时间产生气体的体积或测定产生一定体积的气体所需时间
测定一定时间产生气体的体积或测定产生一定体积的气体所需时间
.实验二:已知2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2↑,在酸性高锰酸钾溶液和草酸溶液反应时,发现开始一段时间,反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快.
(3)针对上述实验现象,某同学认为KMnO4与H2C2O4反应是放热反应,导致溶液温度升高,反应速率加快.从影响化学反应速率的因素看,你的猜想还可能是
催化剂
催化剂
的影响.(4)若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液试剂外,还需要选择的试剂最合理的是
B
B
A、硫酸钾 B、硫酸锰 C、水 D、氯化锰.
根据下列化学方程式:2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O、2FeCl2+Cl2=2FeCl3、2FeCl3+2KI=2FeCl2+2KCl+I2,判断各物质氧化性由大到小的顺序正确的是( )
查看习题详情和答案>>
(1)根据下列几种粒子的结构示意图,回答问题:
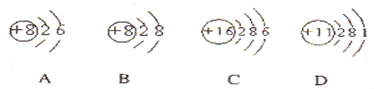
①其中属于阴离子的是
②试写出A、C、D三种元素形成的一种化合物在水溶液中的电离方程式
(2)已知氢元素有11H、12H、13H三种核素,氧元素也有816O、817O、818O三种核素,则它们所形成的水分子共有
(3)实验室可以用高锰酸钾和浓盐酸反应制取氯气,反应的化学方程式如下:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O]
①在该反应中,氧化剂是
②当有0.20mol电子发生转移时,生成氯气的体积为
查看习题详情和答案>>
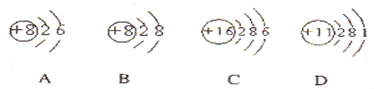
①其中属于阴离子的是
B
B
,属于金属元素的是D
D
.(填编号)②试写出A、C、D三种元素形成的一种化合物在水溶液中的电离方程式
Na2SO4═2Na++SO42-
Na2SO4═2Na++SO42-
.或Na2SO3═2Na++SO32-
或Na2SO3═2Na++SO32-
(2)已知氢元素有11H、12H、13H三种核素,氧元素也有816O、817O、818O三种核素,则它们所形成的水分子共有
18
18
种.(3)实验室可以用高锰酸钾和浓盐酸反应制取氯气,反应的化学方程式如下:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O]
①在该反应中,氧化剂是
KMnO4
KMnO4
,还原剂是HCl
HCl
.②当有0.20mol电子发生转移时,生成氯气的体积为
2.24
2.24
L(标准状况)