摘要: 在金属晶体中, 由于金属原子的价电子比较 , 容易 价电子变成金属离子.这些释出的价电子在 可以自由的运动, 这些电子叫做 .
网址:http://m.1010jiajiao.com/timu3_id_346476[举报]
原子数相同、电子总数相同的分子,互称为等电子体.
(I)已知A、B、C、D、E和F六种微粒都是由两种元素的原子组成,所含原子数目依次为2、3、4、4、5和5,且都含有10个电子,又知D和F为阳离子.
请回答:
(1)A、B、C各自形成的晶体熔沸点高的主要原因是 .
(2)C的立体结构为 形,上述六种微粒中与C立体结构相似的是 (填电子式).
(3)E、F的立体结构类型相同原因是E、F的中心原子均采用 杂化,形成等性杂化轨道.
(Ⅱ)CO与N2互为等电子体.
(4)根据上表CO与N2键能判断:CO与N2分子中成键的方式相似,都包含 (写出成键方式及数目);CO的总键能大于N2的总键能,但CO比N2更容易参加化学反应的原因是 .
(5)Fe、Co、Ni等金属能与CO反应的原因与这些金属原子的电子层结构有关.Fe原子的价电子排布式为 ;Ni原子的核外电子运动状态有 种.金属镍(Ni)在CO气流中轻微加热可生成液态的Ni(CO)4,它易溶于非极性溶剂,在423K温度下就分解生成Ni和CO,从而得到高纯度的镍粉.据此可判断Ni(CO)4晶体属于 (填晶体类型);Ni(CO)4是配合物,配位体是 .
查看习题详情和答案>>
(I)已知A、B、C、D、E和F六种微粒都是由两种元素的原子组成,所含原子数目依次为2、3、4、4、5和5,且都含有10个电子,又知D和F为阳离子.
请回答:
(1)A、B、C各自形成的晶体熔沸点高的主要原因是
(2)C的立体结构为
(3)E、F的立体结构类型相同原因是E、F的中心原子均采用
(Ⅱ)CO与N2互为等电子体.
| A-B | A=B | A≡B | ||||
CO |
键能(KJ/mol) | 357.7 | 798.9 | 1071.9 | ||
| 键能差值(KJ/mol) | 441.2 | 273 | ||||
| N2 | 键能(KJ/mol) | 154.8 | 418.4 | 941.7 | ||
| 键能差值(KJ/mol) | 263.6 | 523.3 | ||||
(5)Fe、Co、Ni等金属能与CO反应的原因与这些金属原子的电子层结构有关.Fe原子的价电子排布式为
用于金属焊接的某种焊条,其药皮由大理石、水泥、硅铁等配制而成。
(1)Al的原子结构示意图为 ;其价电子核外电子排布式为 ,Al与NaOH溶液反应的离子方程式为:
(2)30Si的原子的中子数为 ;SiO2晶体类型为 晶体
(3)Al3+与Yn-的电子数相同,Y所在族的各元素的氢化物的水溶液均显酸性,则该族氢化物中沸点最低的是 。
(4)焊接过程中,药皮在高温下产生了熔渣和使金属不被氧化的气体,该气体是
查看习题详情和答案>>
用于金属焊接的某种焊条,其药皮由大理石、水泥、硅铁等配制而成。
(1)Al的原子结构示意图为 ;其价电子核外电子排布式为 ,Al与NaOH溶液反应的离子方程式为:
(2)30Si的原子的中子数为 ;SiO2晶体类型为 晶体
(3)Al3+与Yn-的电子数相同,Y所在族的各元素的氢化物的水溶液均显酸性,则该族氢化物中沸点最低的是 。
(4)焊接过程中,药皮在高温下产生了熔渣和使金属不被氧化的气体,该气体是
查看习题详情和答案>>
有原子序数依次增大的A、B、C、D、E五种元素,A是短周期中族序数等于周期数的非金属元素;B元素的原子既不易失去,也不易得到电子,其基态原子每种轨道中电子数相同;C元素的价电子构型为nsnnpn+1;D的最外层电子数与电子层数之比为3∶1;E是地壳中含量仅次于铝的金属元素,其合金用途最广,用量最大。
(1)B与D形成的非极性分子中中心原子的孤电子对数是________,中心原子的杂化轨道类型为________。
(2)A分别与B、C、D能形成电子数为10的化合物,它们的沸点由高到低的顺序是________,它们的稳定性由弱到强的顺序是________。
B、C、D三种元素的电负性由大到小的顺序是________(用元素符号表示),第一电离能由大到小的顺序是________(用元素符号表示)。
(5)一个C的单质分子中存在________个π键、________个σ键。
(6)E的三种同素异形体,晶胞如图所示:
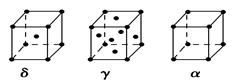
其中晶胞γ的堆积模型中E原子的配位数为________,该晶胞中所含原子数为________。
(1)B与D形成的非极性分子中中心原子的孤电子对数是________,中心原子的杂化轨道类型为________。
(2)A分别与B、C、D能形成电子数为10的化合物,它们的沸点由高到低的顺序是________,它们的稳定性由弱到强的顺序是________。
B、C、D三种元素的电负性由大到小的顺序是________(用元素符号表示),第一电离能由大到小的顺序是________(用元素符号表示)。
(5)一个C的单质分子中存在________个π键、________个σ键。
(6)E的三种同素异形体,晶胞如图所示:

其中晶胞γ的堆积模型中E原子的配位数为________,该晶胞中所含原子数为________。