��Ŀ����
��ԭ���������������A��B��C��D��E����Ԫ�أ�A�Ƕ������������������������ķǽ���Ԫ�أ�BԪ�ص�ԭ�ӼȲ���ʧȥ��Ҳ���õ����ӣ����̬ԭ��ÿ�ֹ���е�������ͬ��CԪ�صļ۵��ӹ���Ϊnsnnpn��1��D����������������Ӳ���֮��Ϊ3��1��E�ǵؿ��к������������Ľ���Ԫ�أ���Ͻ���;��㣬�������
(1)B��D�γɵķǼ��Է���������ԭ�ӵŵ��Ӷ�����________������ԭ�ӵ��ӻ��������Ϊ________��
(2)A�ֱ���B��C��D���γɵ�����Ϊ10�Ļ�������ǵķе��ɸߵ��͵�˳����________�����ǵ��ȶ���������ǿ��˳����________��
B��C��D����Ԫ�صĵ縺���ɴ�С��˳����________(��Ԫ�ط��ű�ʾ)����һ�������ɴ�С��˳����________(��Ԫ�ط��ű�ʾ)��
(5)һ��C�ĵ��ʷ����д���________���м���________���Ҽ���
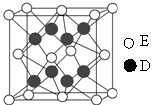
(6)E������ͬ�������壬������ͼ��ʾ��
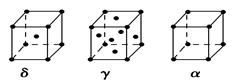
���о����õĶѻ�ģ����Eԭ�ӵ���λ��Ϊ________���þ���������ԭ����Ϊ________��
(1)B��D�γɵķǼ��Է���������ԭ�ӵŵ��Ӷ�����________������ԭ�ӵ��ӻ��������Ϊ________��
(2)A�ֱ���B��C��D���γɵ�����Ϊ10�Ļ�������ǵķе��ɸߵ��͵�˳����________�����ǵ��ȶ���������ǿ��˳����________��
B��C��D����Ԫ�صĵ縺���ɴ�С��˳����________(��Ԫ�ط��ű�ʾ)����һ�������ɴ�С��˳����________(��Ԫ�ط��ű�ʾ)��
(5)һ��C�ĵ��ʷ����д���________���м���________���Ҽ���
(6)E������ͬ�������壬������ͼ��ʾ��

���о����õĶѻ�ģ����Eԭ�ӵ���λ��Ϊ________���þ���������ԭ����Ϊ________��
(1)0��sp�ӻ�
(2)H2O��NH3��CH4��CH4��NH3��H2O
(3)ֱ���Ρ�ƽ�������Ρ�(4)O>N>C��N>O>C
(5)2��1��(6)12��4
(2)H2O��NH3��CH4��CH4��NH3��H2O
(3)ֱ���Ρ�ƽ�������Ρ�(4)O>N>C��N>O>C
(5)2��1��(6)12��4
�������������������������ķǽ���Ԫ��ֻ��H����AΪH����BԪ��ԭ�ӵĵ�ʧ�����������ж�BΪC����1s��2s��2p�������2�����ӣ�CԪ�صļ۵��ӹ���Ϊnsnnpn��1����s�������2�����ӿ�֪nֻ�ܵ���2����CΪN������������������Ӳ����Ĺ�ϵ��֪DΪO����E�ڵؿ��к�����֪��ΪFe��(1)C��O�γɵķǼ��Է���ΪCO2�������ʽΪ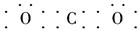 ������ԭ��Ϊ̼ԭ�ӣ��ɵ���ʽ��֪������ԭ���µ��Ӷԣ�CO2Ϊֱ���η��ӣ�����sp�ӻ���ʽ��(2)H��C��N��O�γɵ�10���ӷ���ΪCH4��NH3��H2O��������ˮΪҺ̬���е���ߣ����ΪNH3��CH4�е���ͣ�ͬ����Ԫ�ش����ң��⻯����ȶ�������ǿ�����ȶ���˳��ΪCH4<NH3<H2O��(3)HCN�Ľṹʽ���Ա�ʾΪ
������ԭ��Ϊ̼ԭ�ӣ��ɵ���ʽ��֪������ԭ���µ��Ӷԣ�CO2Ϊֱ���η��ӣ�����sp�ӻ���ʽ��(2)H��C��N��O�γɵ�10���ӷ���ΪCH4��NH3��H2O��������ˮΪҺ̬���е���ߣ����ΪNH3��CH4�е���ͣ�ͬ����Ԫ�ش����ң��⻯����ȶ�������ǿ�����ȶ���˳��ΪCH4<NH3<H2O��(3)HCN�Ľṹʽ���Ա�ʾΪ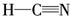 ���ռ乹����ֱ���Σ�CH2O�ĽṹʽΪ
���ռ乹����ֱ���Σ�CH2O�ĽṹʽΪ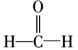 ��̼ԭ�Ӳ�ȡsp2�ӻ�����Ϊƽ�������νṹ��(4)ͬ����Ԫ�ش����ң��縺������ǿ���ʵ縺�Թ�ϵΪC<N<O��ͬ����Ԫ�ش����ң���һ�����ܻ�����������������ƣ�������N��p������Ӵ��ڰ����״̬����һ�����ܽϴʵ�һ�����ܹ�ϵΪC<O<N��(5)N2�ṹʽΪNN�����к���2���м���1���Ҽ���(6)������Ϊ���������ѻ�������λ��Ϊ12���þ���������ԭ����Ϊ8��
��̼ԭ�Ӳ�ȡsp2�ӻ�����Ϊƽ�������νṹ��(4)ͬ����Ԫ�ش����ң��縺������ǿ���ʵ縺�Թ�ϵΪC<N<O��ͬ����Ԫ�ش����ң���һ�����ܻ�����������������ƣ�������N��p������Ӵ��ڰ����״̬����һ�����ܽϴʵ�һ�����ܹ�ϵΪC<O<N��(5)N2�ṹʽΪNN�����к���2���м���1���Ҽ���(6)������Ϊ���������ѻ�������λ��Ϊ12���þ���������ԭ����Ϊ8��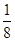 ��6��
��6��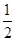 ��4��
��4��
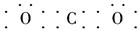 ������ԭ��Ϊ̼ԭ�ӣ��ɵ���ʽ��֪������ԭ���µ��Ӷԣ�CO2Ϊֱ���η��ӣ�����sp�ӻ���ʽ��(2)H��C��N��O�γɵ�10���ӷ���ΪCH4��NH3��H2O��������ˮΪҺ̬���е���ߣ����ΪNH3��CH4�е���ͣ�ͬ����Ԫ�ش����ң��⻯����ȶ�������ǿ�����ȶ���˳��ΪCH4<NH3<H2O��(3)HCN�Ľṹʽ���Ա�ʾΪ
������ԭ��Ϊ̼ԭ�ӣ��ɵ���ʽ��֪������ԭ���µ��Ӷԣ�CO2Ϊֱ���η��ӣ�����sp�ӻ���ʽ��(2)H��C��N��O�γɵ�10���ӷ���ΪCH4��NH3��H2O��������ˮΪҺ̬���е���ߣ����ΪNH3��CH4�е���ͣ�ͬ����Ԫ�ش����ң��⻯����ȶ�������ǿ�����ȶ���˳��ΪCH4<NH3<H2O��(3)HCN�Ľṹʽ���Ա�ʾΪ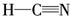 ���ռ乹����ֱ���Σ�CH2O�ĽṹʽΪ
���ռ乹����ֱ���Σ�CH2O�ĽṹʽΪ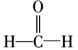 ��̼ԭ�Ӳ�ȡsp2�ӻ�����Ϊƽ�������νṹ��(4)ͬ����Ԫ�ش����ң��縺������ǿ���ʵ縺�Թ�ϵΪC<N<O��ͬ����Ԫ�ش����ң���һ�����ܻ�����������������ƣ�������N��p������Ӵ��ڰ����״̬����һ�����ܽϴʵ�һ�����ܹ�ϵΪC<O<N��(5)N2�ṹʽΪNN�����к���2���м���1���Ҽ���(6)������Ϊ���������ѻ�������λ��Ϊ12���þ���������ԭ����Ϊ8��
��̼ԭ�Ӳ�ȡsp2�ӻ�����Ϊƽ�������νṹ��(4)ͬ����Ԫ�ش����ң��縺������ǿ���ʵ縺�Թ�ϵΪC<N<O��ͬ����Ԫ�ش����ң���һ�����ܻ�����������������ƣ�������N��p������Ӵ��ڰ����״̬����һ�����ܽϴʵ�һ�����ܹ�ϵΪC<O<N��(5)N2�ṹʽΪNN�����к���2���м���1���Ҽ���(6)������Ϊ���������ѻ�������λ��Ϊ12���þ���������ԭ����Ϊ8��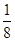 ��6��
��6��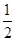 ��4��
��4��
��ϰ��ϵ�д�
�����Ŀ