题目内容
原子数相同、电子总数相同的分子,互称为等电子体.
(I)已知A、B、C、D、E和F六种微粒都是由两种元素的原子组成,所含原子数目依次为2、3、4、4、5和5,且都含有10个电子,又知D和F为阳离子.
请回答:
(1)A、B、C各自形成的晶体熔沸点高的主要原因是 .
(2)C的立体结构为 形,上述六种微粒中与C立体结构相似的是 (填电子式).
(3)E、F的立体结构类型相同原因是E、F的中心原子均采用 杂化,形成等性杂化轨道.
(Ⅱ)CO与N2互为等电子体.
(4)根据上表CO与N2键能判断:CO与N2分子中成键的方式相似,都包含 (写出成键方式及数目);CO的总键能大于N2的总键能,但CO比N2更容易参加化学反应的原因是 .
(5)Fe、Co、Ni等金属能与CO反应的原因与这些金属原子的电子层结构有关.Fe原子的价电子排布式为 ;Ni原子的核外电子运动状态有 种.金属镍(Ni)在CO气流中轻微加热可生成液态的Ni(CO)4,它易溶于非极性溶剂,在423K温度下就分解生成Ni和CO,从而得到高纯度的镍粉.据此可判断Ni(CO)4晶体属于 (填晶体类型);Ni(CO)4是配合物,配位体是 .
(I)已知A、B、C、D、E和F六种微粒都是由两种元素的原子组成,所含原子数目依次为2、3、4、4、5和5,且都含有10个电子,又知D和F为阳离子.
请回答:
(1)A、B、C各自形成的晶体熔沸点高的主要原因是
(2)C的立体结构为
(3)E、F的立体结构类型相同原因是E、F的中心原子均采用
(Ⅱ)CO与N2互为等电子体.
| A-B | A=B | A≡B | ||||
CO |
键能(KJ/mol) | 357.7 | 798.9 | 1071.9 | ||
| 键能差值(KJ/mol) | 441.2 | 273 | ||||
| N2 | 键能(KJ/mol) | 154.8 | 418.4 | 941.7 | ||
| 键能差值(KJ/mol) | 263.6 | 523.3 | ||||
(5)Fe、Co、Ni等金属能与CO反应的原因与这些金属原子的电子层结构有关.Fe原子的价电子排布式为
分析:(Ⅰ)A、B、C、D、E和F六种微粒都是由两种元素的原子组成,所含原子数目依次为2、3、4、4、5,和5,且都含有10个电子,又知D和F为阳离子,则A为HF、B为H2O、C为NH3、D为H3O+、E为CH4、F为NH4+,据此解答;
(Ⅱ)(4)CO与N2分子中成键的方式相似,分子中都形成三键;由表中数据可知,第一个π键的键能CO比N2的小很多,CO的第一个π键比N2容易断裂;
(5)Fe原子核外电子数为26,根据核外电子排布规律书写其价电子排布式;
原子中没有运动状态相同的电子,核外有几个电子就有几种运动状态;
Ni(CO)4为液态,熔点较低,在423K温度下就分解生成Ni和CO,稳定性较差,其易溶于非极性溶剂,应为分子晶体;
Ni原子有空轨道,CO含有孤对电子,CO为配体.
(Ⅱ)(4)CO与N2分子中成键的方式相似,分子中都形成三键;由表中数据可知,第一个π键的键能CO比N2的小很多,CO的第一个π键比N2容易断裂;
(5)Fe原子核外电子数为26,根据核外电子排布规律书写其价电子排布式;
原子中没有运动状态相同的电子,核外有几个电子就有几种运动状态;
Ni(CO)4为液态,熔点较低,在423K温度下就分解生成Ni和CO,稳定性较差,其易溶于非极性溶剂,应为分子晶体;
Ni原子有空轨道,CO含有孤对电子,CO为配体.
解答:解:(Ⅰ)A、B、C、D、E和F六种微粒都是由两种元素的原子组成,所含原子数目依次为2、3、4、4、5,和5,且都含有10个电子,又知D和F为阳离子,则A为HF、B为H2O、C为NH3、D为H3O+、E为CH4、F为NH4+,
(1)A、B、C分别为HF、H2O、NH3,均能形成分子间氢键,分子间相互作用增大,故晶体的沸点较高,
故答案为:A、B、C分别为HF、H2O、NH3,均能形成分子间氢键,分子间相互作用增大;
(2)C为NH3,其立体结构为三角锥形,HF为直线型、H2O为V型、CH4与NH4+为正四面体型,H3O+为三角锥型,其电子式为: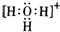 ,
,
故答案为:三角锥;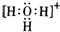 ;
;
(3)CH4、F为NH4+的立体结构类型,中心原子C、N原子价层电子对数为4,不含孤对电子,均采用sp3杂化,形成等性杂化轨道,
故答案为:sp3;
(Ⅱ)(4)CO与N2分子中成键的方式相似,分子中都形成三键,含有1个δ键,2个π键;由表中数据可知,第一个π键的键能CO比N2的小很多,CO的第一个π键比N2容易断裂,故CO比N2更容易参加化学反应,
故答案为:1个δ键,2个π键;第一个π键的键能CO比N2的小很多,CO的第一个π键比N2容易断裂;
(5)Fe原子核外电子数为26,核外电子排布为1s22s22p63s23p63d64s2,其价电子排布式为3d64s2;
原子中没有运动状态相同的电子,Ni原子核外有28个电子,故Ni原子核外电子有28种运动状态;
Ni(CO)4为液态,熔点较低,在423K温度下就分解生成Ni和CO,稳定性较差,其易溶于非极性溶剂,应为分子晶体;
Ni原子有空轨道,CO含有孤对电子,故CO为配体,
故答案为:3d64s2;28;分子晶体;CO.
(1)A、B、C分别为HF、H2O、NH3,均能形成分子间氢键,分子间相互作用增大,故晶体的沸点较高,
故答案为:A、B、C分别为HF、H2O、NH3,均能形成分子间氢键,分子间相互作用增大;
(2)C为NH3,其立体结构为三角锥形,HF为直线型、H2O为V型、CH4与NH4+为正四面体型,H3O+为三角锥型,其电子式为:
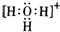 ,
,故答案为:三角锥;
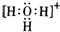 ;
;(3)CH4、F为NH4+的立体结构类型,中心原子C、N原子价层电子对数为4,不含孤对电子,均采用sp3杂化,形成等性杂化轨道,
故答案为:sp3;
(Ⅱ)(4)CO与N2分子中成键的方式相似,分子中都形成三键,含有1个δ键,2个π键;由表中数据可知,第一个π键的键能CO比N2的小很多,CO的第一个π键比N2容易断裂,故CO比N2更容易参加化学反应,
故答案为:1个δ键,2个π键;第一个π键的键能CO比N2的小很多,CO的第一个π键比N2容易断裂;
(5)Fe原子核外电子数为26,核外电子排布为1s22s22p63s23p63d64s2,其价电子排布式为3d64s2;
原子中没有运动状态相同的电子,Ni原子核外有28个电子,故Ni原子核外电子有28种运动状态;
Ni(CO)4为液态,熔点较低,在423K温度下就分解生成Ni和CO,稳定性较差,其易溶于非极性溶剂,应为分子晶体;
Ni原子有空轨道,CO含有孤对电子,故CO为配体,
故答案为:3d64s2;28;分子晶体;CO.
点评:本题考查物质推断、分子结构与性质、杂化理论、化学键、核外电子排布规律、晶体类型与性质、配合物等,难度不大,注意对基础知识的全面掌握.

练习册系列答案
 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案
相关题目
原子数相同、电子总数相同的分子,互称为等电子体.
Ⅰ.已知A、B、C、D和E五种分子所含原子的数目依次为1、2、3、6和6,且都含有18个电子,又知B、C和D是由两种元素的原子组成,且D分子中两种原子个数比为1:2.
请回答:
(1)组成A分子的原子的元素符号是 ;已知E是有毒的有机物,E的熔、沸点比CH4的熔、沸点高,其主要原因是 .
(2)C的立体结构呈 形,该分子属于 分子(填“极性”或“非极性”);
(3)火箭中可充入四氧化二氮和D作为燃料反应生成氮气和水,该反应的化学方程式为 .(不需要写反应条件)
Ⅱ.CO与N2互为等电子体.
(4)CO的总键能大于N2的总键能,但CO比N2容易参加化学反应.
根据下表数据,说明CO比N2活泼的原因是 .
(5)它们的分子中都包含 个σ键, 个π键.
(6)Fe、Co、Ni等金属能与CO反应的原因与这些金属原子的电子层结构有关.
Ni原子的价电子排布式为 .Fe(CO)5常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)5晶体属于 (填晶体类型);Fe(CO)5是配合物,配体是 .
Ⅰ.已知A、B、C、D和E五种分子所含原子的数目依次为1、2、3、6和6,且都含有18个电子,又知B、C和D是由两种元素的原子组成,且D分子中两种原子个数比为1:2.
请回答:
(1)组成A分子的原子的元素符号是
(2)C的立体结构呈
(3)火箭中可充入四氧化二氮和D作为燃料反应生成氮气和水,该反应的化学方程式为
Ⅱ.CO与N2互为等电子体.
(4)CO的总键能大于N2的总键能,但CO比N2容易参加化学反应.
根据下表数据,说明CO比N2活泼的原因是
| A-B | A=B | A≡B | ||
| CO | 键能(kJ/mol) | 357.7 | 798.9 | 1071.9 |
| 键能差值(kJ/mol) | 441.2 273 | |||
| N2 | 键能(kJ/mol) | 154.8 | 418.4 | 941.7 |
| 键能差值(kJ/mol) | 263.6 523.3 | |||
(6)Fe、Co、Ni等金属能与CO反应的原因与这些金属原子的电子层结构有关.
Ni原子的价电子排布式为