摘要:‚„,„…,ƒ†
网址:http://m.1010jiajiao.com/timu3_id_346247[举报]
某硫酸厂进行硫铁矿(主要成分是FeS2)含量的测定.取样品0.1000g在空气中充分灼烧,将生成的SO2气体与足量的Fe2(SO4)3溶液反应,反应后的溶液用浓度为0.02000mol?L-1
的KMnO4溶液滴定至终点,消耗KMnO4溶液30.00mL.已知:
SO2+2Fe3++2H2O=SO2-4+2Fe2++4H+;5Fe2++MnO-4+8H+=5Fe3++Mn2++4H2O
(1)滴定前
(2)样品中FeS2的质量分数是
(3)若灼烧6g纯净FeS2产生的SO2全部被氧化为SO3气体,再将产生的SO3气体全部与水化合生成硫酸溶液时,放出13.03kJ热量,写出SO3气体转化为H2SO4溶液的热化学方程式:
(4)二氧化硫和氮的氧化物是大气的主要污染物,防止和治理环境污染是当前环保工作的重要研究内容之一.
①用CH4催化还原NOx为N2可以消除氮氧化物的污染.试写出总反应的化学方程式:
②新型纳米材料氧缺位铁酸锌(ZnFe2Ox),常温下它能使工业废气中的氮的氧化物、SO2分解,减小工业废气对环境的影响,它可由铁酸锌(ZnFe2O4)经高温还原制得.转化流程如下图所示:
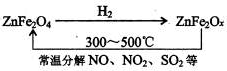
若2mol ZnFe2Ox与SO2反应可生成0.75mol S,则x=
查看习题详情和答案>>
的KMnO4溶液滴定至终点,消耗KMnO4溶液30.00mL.已知:
SO2+2Fe3++2H2O=SO2-4+2Fe2++4H+;5Fe2++MnO-4+8H+=5Fe3++Mn2++4H2O
(1)滴定前
不需要
不需要
(填“需要”或“不需要”)滴加指示剂.滴定至终点的判断方法是溶液变成紫红色且半分钟内不褪色
溶液变成紫红色且半分钟内不褪色
.(2)样品中FeS2的质量分数是
90%
90%
(假定杂质不参加反应).(3)若灼烧6g纯净FeS2产生的SO2全部被氧化为SO3气体,再将产生的SO3气体全部与水化合生成硫酸溶液时,放出13.03kJ热量,写出SO3气体转化为H2SO4溶液的热化学方程式:
SO3(g)+H2O(l)═H2SO4(aq)△H=-130.3KJ/mol
SO3(g)+H2O(l)═H2SO4(aq)△H=-130.3KJ/mol
.(4)二氧化硫和氮的氧化物是大气的主要污染物,防止和治理环境污染是当前环保工作的重要研究内容之一.
①用CH4催化还原NOx为N2可以消除氮氧化物的污染.试写出总反应的化学方程式:
xCH4+4NOx═2N2+xCO2+2H2O
xCH4+4NOx═2N2+xCO2+2H2O
.②新型纳米材料氧缺位铁酸锌(ZnFe2Ox),常温下它能使工业废气中的氮的氧化物、SO2分解,减小工业废气对环境的影响,它可由铁酸锌(ZnFe2O4)经高温还原制得.转化流程如下图所示:

若2mol ZnFe2Ox与SO2反应可生成0.75mol S,则x=
3.25
3.25
.(2007?天津)黄铁矿主要成分是FeS2.某硫酸厂在进行黄铁矿成分测定时,取0.1000g样品在空气中充分灼烧,将生成的SO2气体与足量‘Fe2(SO4)3溶液完全反应后,用浓度为0.02000mol/L的K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7溶液25.00mL.
已知:SO2+2Fe3++2H2O═SO2-+2Fe2++4H+
Cr2O
+6Fe2++14H+═2Cr3++6Fe3++7H2O
(1)样品中FeS2的质量分数是(假设杂质不参加反应)
(2)若灼烧6g FeS2产生的SO2全部转化为SO3气体时放出9.83kJ热量,产生的SO3与水全部化合生成H2SO4,放出13.03kJ热量,写出SO3气体转化为H2SO4的热化学方程式:
(3)煅烧10t上述黄铁矿,理论上产生SO2的体积(标准状况)为
查看习题详情和答案>>
已知:SO2+2Fe3++2H2O═SO2-+2Fe2++4H+
Cr2O
2- 7 |
(1)样品中FeS2的质量分数是(假设杂质不参加反应)
90.00%
90.00%
.(2)若灼烧6g FeS2产生的SO2全部转化为SO3气体时放出9.83kJ热量,产生的SO3与水全部化合生成H2SO4,放出13.03kJ热量,写出SO3气体转化为H2SO4的热化学方程式:
SO3(g)+H2O(1)═H2SO4(1);△H═-130.3 kJ/mol
SO3(g)+H2O(1)═H2SO4(1);△H═-130.3 kJ/mol
.(3)煅烧10t上述黄铁矿,理论上产生SO2的体积(标准状况)为
3.36×106
3.36×106
L,制得98%的硫酸质量为15
15
t,SO2全部转化为H2SO4时放出的热量是3.43×107
3.43×107
kJ.平衡指的是两个相反方向的变化最后所处的运动状态;在平衡时,两种变化仍在继续进行,但是它们的速率相等;根据变化的性质可分为物理平衡和化学平衡,中学阶段涉及的平衡有气体可逆反应的平衡、酸碱电离平衡、水解平衡及沉淀-溶解平衡等等.
(1)现有容积为1L的恒温恒容密闭容器,向其中加入2mol A气体和2mol B气体后发生如下反应:
A(g)+B(g)?C(g)△H=-a kJ?mol-1
20s后,反应达到平衡状态,生成1mol C气体,放出热量Q1kJ.回答下列问题.
①计算20s内B气体的平均化学反应速率为
②保持容器温度和容积不变,若改为向其中加入1mol C气体,反应达到平衡时,吸收热量Q2 kJ,则Q1与Q2的相互关系正确的是
(A)Q1+Q2=a (B) Q1+2Q2<2a (C)Q1+2Q2>2a (D)Q1+Q2<a
③在原平衡基础上,保持容器温度和容积不变,向容器中再通入b mol A气体(b>0)时,v(正)
,则b=
(2)常温下,将V mL、0.1000mol?L-1氢氧化钠溶液逐滴加入到20.00mL、0.1000mol?L-1醋酸溶液中,充分反应.回答下列问题(忽略溶液体积的变化).
①如果溶液pH=7,此时V的取值
②如果V=40.00,则此时溶液中c(OH-)-c(H+)-c(CH3COOH)=
或0.033
或0.033mol?L-1.
查看习题详情和答案>>
(1)现有容积为1L的恒温恒容密闭容器,向其中加入2mol A气体和2mol B气体后发生如下反应:
A(g)+B(g)?C(g)△H=-a kJ?mol-1
20s后,反应达到平衡状态,生成1mol C气体,放出热量Q1kJ.回答下列问题.
①计算20s内B气体的平均化学反应速率为
0.05mol/(L?s)
0.05mol/(L?s)
,写出该反应的平衡常数表达式K=
| c(C) |
| c(A)?c(B) |
K=
.| c(C) |
| c(A)?c(B) |
②保持容器温度和容积不变,若改为向其中加入1mol C气体,反应达到平衡时,吸收热量Q2 kJ,则Q1与Q2的相互关系正确的是
C
C
(填字母).(A)Q1+Q2=a (B) Q1+2Q2<2a (C)Q1+2Q2>2a (D)Q1+Q2<a
③在原平衡基础上,保持容器温度和容积不变,向容器中再通入b mol A气体(b>0)时,v(正)
>
>
v(逆)(填“>”、“<”或“=”),重新达平衡后,C气体的平衡体积分数?(C)=| 1 |
| 3 |
1.33
1.33
.(2)常温下,将V mL、0.1000mol?L-1氢氧化钠溶液逐滴加入到20.00mL、0.1000mol?L-1醋酸溶液中,充分反应.回答下列问题(忽略溶液体积的变化).
①如果溶液pH=7,此时V的取值
<
<
20.00(填“>”、“<”或“=”),而溶液中c(Na+)、c(CH3COO-)、c(H+)、c(OH-)的大小关系为c(Na+)=c(CH3COO-)>c(H+)=c(OH-)
c(Na+)=c(CH3COO-)>c(H+)=c(OH-)
.②如果V=40.00,则此时溶液中c(OH-)-c(H+)-c(CH3COOH)=
| 1 |
| 30 |
| 1 |
| 30 |
中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~50%.
(1)有效“减碳”的手段之一是节能,下列制氢方法最节能的是
A.电解水制氢:2H2O
2H2↑+O2↑
B.高温使水分解制氢:2H2O
2H2↑+O2↑
C.太阳光催化分解水制氢:2H2O
2H2↑+O2↑
D.天然气制氢:CH4+H2O
CO+3H2
(2)CO2可转化成有机物实现碳循环.将2molCO2和6molH2充入容积为3L的密闭容器中,在一定温度和压强条件下发生了下列反应:CO2(g)+3H2 (g)?CH3OH(g)+H2O(g)△H=-49.0kJ?mol-1.反应在2分钟时达到了平衡.
①用H2与CO2浓度的变化表示该反应的速率,以它们的速率表示反应达到平衡的关系式是
②达到平衡时,改变温度(T)和压强(P),反应混合物中CH3OH的“物质的量分数”变化情况如图1所示,关于温度(T)和压强(P)的关系判断正确的是
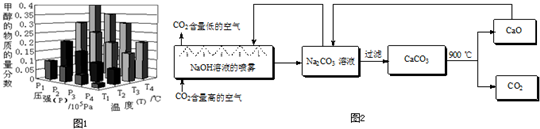
A.P3>P2 T3>T2
B.P2>P4 T4>T2
C.P1>P3 T1>T3
D.P1>P4 T2>T3
(3)工业上,CH3OH也可由CO和H2合成.参考合成反应CO(g)+2H2(g)?CH3OH(g)的平
衡常数:
下列说法正确的是
A.该反应正反应是放热反应
B.该反应在低温下不能自发进行,高温下可自发进行,说明该反应△S<0
C.在T℃时,1L密闭容器中,投入0.1mol CO和0.2mol H2,达到平衡时,CO转化率为50%,则此时的平衡常数为100
D.工业上采用稍高的压强(5Mpa)和250℃,是因为此条件下,原料气转化率最高
(4)二氧化碳的捕捉与封存是实现温室气体减排的重要途径之一,科学家利用NaOH溶液喷淋“捕捉”空气中的CO2(如图2).
以CO2与NH3为原料可合成化肥尿素[CO(NH2)2].已知:
2NH3(g)+CO2(g)=NH2CO2NH4(s)△H=-159.47kJ?mol-1
NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g)△H=+116.49kJ?mol-1
H2O(l)=H2O(g)△H=+88.0kJ?mol-1
试写出NH3和CO2合成尿素和液态水的热化学方程式
查看习题详情和答案>>
(1)有效“减碳”的手段之一是节能,下列制氢方法最节能的是
C
C
:A.电解水制氢:2H2O
| ||
B.高温使水分解制氢:2H2O
| ||
C.太阳光催化分解水制氢:2H2O
| ||
| 太阳光 |
D.天然气制氢:CH4+H2O
| ||
(2)CO2可转化成有机物实现碳循环.将2molCO2和6molH2充入容积为3L的密闭容器中,在一定温度和压强条件下发生了下列反应:CO2(g)+3H2 (g)?CH3OH(g)+H2O(g)△H=-49.0kJ?mol-1.反应在2分钟时达到了平衡.
①用H2与CO2浓度的变化表示该反应的速率,以它们的速率表示反应达到平衡的关系式是
3υ(CO2)正=υ(H2)逆
3υ(CO2)正=υ(H2)逆
.②达到平衡时,改变温度(T)和压强(P),反应混合物中CH3OH的“物质的量分数”变化情况如图1所示,关于温度(T)和压强(P)的关系判断正确的是
CD
CD
(填序号).
A.P3>P2 T3>T2
B.P2>P4 T4>T2
C.P1>P3 T1>T3
D.P1>P4 T2>T3
(3)工业上,CH3OH也可由CO和H2合成.参考合成反应CO(g)+2H2(g)?CH3OH(g)的平
衡常数:
| 温度/℃ | 0 | 100 | 200 | 300 | 400 |
| 平衡常数 | 667 | 13 | 1.9×10-2 | 2.4×10-4 | 1×10-5 |
AC
AC
.A.该反应正反应是放热反应
B.该反应在低温下不能自发进行,高温下可自发进行,说明该反应△S<0
C.在T℃时,1L密闭容器中,投入0.1mol CO和0.2mol H2,达到平衡时,CO转化率为50%,则此时的平衡常数为100
D.工业上采用稍高的压强(5Mpa)和250℃,是因为此条件下,原料气转化率最高
(4)二氧化碳的捕捉与封存是实现温室气体减排的重要途径之一,科学家利用NaOH溶液喷淋“捕捉”空气中的CO2(如图2).
以CO2与NH3为原料可合成化肥尿素[CO(NH2)2].已知:
2NH3(g)+CO2(g)=NH2CO2NH4(s)△H=-159.47kJ?mol-1
NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g)△H=+116.49kJ?mol-1
H2O(l)=H2O(g)△H=+88.0kJ?mol-1
试写出NH3和CO2合成尿素和液态水的热化学方程式
2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(l)△H=-130.98kJ?mol-1
2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(l)△H=-130.98kJ?mol-1
.有机物G(分子式为 C13H18O2)是一种香料,其合成路线如下图所示。其中A是一种相对分子质量为70的烃,核磁共振氢谱有四个峰且峰面积之比为6:2:1:1;B是一种芳香族含氧衍生物,相对分子质量在100-130之间,B中含氧元素的质量分数为13.1%,F可以使溴的四氯化碳溶液褪色。
已知: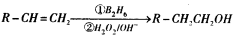
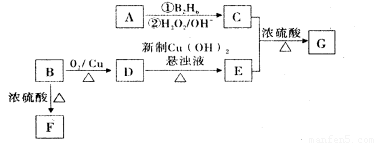
请回答下面的问题:
(1)化合物A的结构简式为____,按系统命名法命名的名称是____。
(2)化合物B的分子式为____,B在上图转化中发生的反应所属的反应类型是____。
(3)写出D→E反应的化学方程式____。
(4)写出C与E生成G反应的化学方程式____。
(5)E的同分异构体有多种,写出符合下列条件的所有物质的结构简式____。
a.属于芳香族化合物且苯环上的一氯代物有两种;b.含有“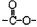 ”基团
”基团
查看习题详情和答案>>