摘要:28.在元素周期表中第三周期元素组成的单质中.属于金属晶体的是 .属于原子晶体的是 .属于分子晶体的是 ,其中熔点最高的是 .熔点最低的 ,离子半径最小的是 .还原性最强的是 .氧化性最强的是 .
网址:http://m.1010jiajiao.com/timu3_id_345859[举报]
在第三周期元素组成的单质中,属于金属晶体的是______,属于原子晶体的是______,属于分子晶体的是________;其熔点最高的是________,最低的是________;还原性最强的是______,氧化性最强的是______,用电子式表示两者形成化合物的过程_________.
查看习题详情和答案>> 短周期元素A、B、C、D、E、F原子序数依次增大,A与C可形成A2C2和A2C两种化合物;B的最高价氧化物对应的水化物甲与气体BA3化合生成离子化合物乙;D与A位于同一主族:E与C形成的化合物是大气污染物,容易形成酸雨;F元素最高化合价与最低化合价的代数和为6.
短周期元素A、B、C、D、E、F原子序数依次增大,A与C可形成A2C2和A2C两种化合物;B的最高价氧化物对应的水化物甲与气体BA3化合生成离子化合物乙;D与A位于同一主族:E与C形成的化合物是大气污染物,容易形成酸雨;F元素最高化合价与最低化合价的代数和为6.(1)E在元素周期表中的位置是
第三周期第ⅥA族
第三周期第ⅥA族
(2)由A、C、F三种元素按原子个数比、1:1:1组成的化合物与BA3反应生成B的单质,写出该反应的化学方程式
3HClO+2NH3=3HCl+N2+3H2O
3HClO+2NH3=3HCl+N2+3H2O
.(3)常温下,若甲、乙两溶液的pH均等于5,则由水电离出的
| c(H+)甲 | c(H+)乙 |
10-4
10-4
;乙溶液中所含离子的物质的量浓度由大到小的顺序是c(NO3-)>c(NH4+)>c(H+)>c(OH-)
c(NO3-)>c(NH4+)>c(H+)>c(OH-)
.(4)用如图所示装置电解由D与F形成盐的饱和溶液时,若阴、阳极都用铁作电极,则阳极的电极反应式为
Fe-2e-=Fe2+
Fe-2e-=Fe2+
,溶液中出现的现象是产生气泡,有白色沉淀生成
产生气泡,有白色沉淀生成
.短周期元素形成的常见非金属固体单质A与常见金属单质B,在加热条件下反应生成化合物C,C与水反应生成白色沉D和气体E,D既能溶于强酸,也能溶于强碱.E在足量空气中燃烧产生刺激性气体G,G在大气中能导致酸雨的形成.E被足量氢氧化钠溶液吸收得到无色溶液F.溶液F在空气中长期放置发生反应,生成物之一为H.H与过氧化钠的结构和化学性质相似,其溶液显黄色.
请回答下列问题:
(1)组成单质A的元素在周期表中的位置是
(2)组成单质B的元素的原子结构示意图为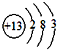
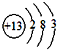 .
.
(3)G与氯酸钠在酸性条件下反应可生成消霉杀菌剂二氧化氯.该反应的氧化剂为
(4)溶液F在空气中长期放置生成H的化学反应万程式为:
(5)H的溶液与稀硫酸反应产生的现象为
查看习题详情和答案>>
请回答下列问题:
(1)组成单质A的元素在周期表中的位置是
第三周期 第ⅥA族
第三周期 第ⅥA族
.(2)组成单质B的元素的原子结构示意图为
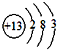
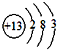
(3)G与氯酸钠在酸性条件下反应可生成消霉杀菌剂二氧化氯.该反应的氧化剂为
氯酸钠(NaClO3)
氯酸钠(NaClO3)
.(4)溶液F在空气中长期放置生成H的化学反应万程式为:
4Na2S+O2+2H2O═4NaOH+2Na2S2(或2Na2S+O2+2H2O═4NaOH+2S,Na2S+S═Na2S2)
4Na2S+O2+2H2O═4NaOH+2Na2S2(或2Na2S+O2+2H2O═4NaOH+2S,Na2S+S═Na2S2)
.(5)H的溶液与稀硫酸反应产生的现象为
溶液由黄色变为无色,产生浅黄色沉淀和臭鸡蛋气味的气体
溶液由黄色变为无色,产生浅黄色沉淀和臭鸡蛋气味的气体
.短周期元素A、B、C、D、E、F的原子序数依次增大.其中A和E、D和F分别位于同一主族,且B的最外层电子数是次外层电子数的2倍,D是地壳中含量最高的元素;化合物X、Y分别由A与C、A与D组成,且X、Y两种分子中均含有10个电子.
请回答下列问题:
(1)元素C在周期表中的位置是第
(2)Y的电子式为
 .
.
(3)比较F和E形成简单离子的半径大小:
(4)一定条件下,A单质和D单质在E的最高价氧化物对应水化物的浓溶液中可以形成燃料电池.请写出该燃料电池的负极反应式:
(5)X的空间构型为
查看习题详情和答案>>
请回答下列问题:
(1)元素C在周期表中的位置是第
二
二
周期ⅤA
ⅤA
族.(2)Y的电子式为


(3)比较F和E形成简单离子的半径大小:
S2->Na+
S2->Na+
(填离子符号).(4)一定条件下,A单质和D单质在E的最高价氧化物对应水化物的浓溶液中可以形成燃料电池.请写出该燃料电池的负极反应式:
H2+2OH-+2e-=2H2O
H2+2OH-+2e-=2H2O
.(5)X的空间构型为
三角锥
三角锥
,工业上生产X的反应中,若每生成a mol X时放出b kJ热量,则该反应的热化学方程式为N2(g)+3H2(g)=2NH3(g)△H=-
kJ/mol
| 2b |
| a |
N2(g)+3H2(g)=2NH3(g)△H=-
kJ/mol
.| 2b |
| a |
短周期元素X、Y、Z、W核电荷数依次增大,X、Z同主族,Z、W同周期,四种元素的原子序数之和为37,在周期表中X是原子半径最小的元素,Y的最外层电子数是内层电子数的3倍.
(1)W在周期表中的位置是第
(2)X与Y 能形成具有18个电子的化合物,此化合物的电子式为

(3)X、Y、Z三种元素组成的化合物中存在
(4)Y、Z、W形成的某种化合物晶体类型是
(5)X和Y形成的化合物沸点比X和W形成的化合物沸点
(6)Z、W两种元素的最高价氧化物对应水化物溶液之间反应的离子方程式为
查看习题详情和答案>>
(1)W在周期表中的位置是第
三
三
周期第ⅦA
ⅦA
族(2)X与Y 能形成具有18个电子的化合物,此化合物的电子式为


(3)X、Y、Z三种元素组成的化合物中存在
离子键、共价键
离子键、共价键
(填“化学键”名称)(4)Y、Z、W形成的某种化合物晶体类型是
离子晶体
离子晶体
(填“晶体类型”名称)(5)X和Y形成的化合物沸点比X和W形成的化合物沸点
高
高
(填“高”或“低”)(6)Z、W两种元素的最高价氧化物对应水化物溶液之间反应的离子方程式为
H++OH-=H2O
H++OH-=H2O
.