网址:http://m.1010jiajiao.com/timu3_id_345657[举报]

(1)由Na2B4O7和NaOH反应制NaBO2的离子方程式为
(2)沉淀A中含有酸不溶物和氢氧化镁杂质,为了分离出氢氧化镁,在沉淀中加过量的酸,过滤得到含Mg2+的滤液,再在滤液加入碱使Mg2+形成氢氧化镁.若加碱前溶液中c(Mg2+)=0.056mol?L-1,那么需调节溶液的pH=
(3)已知纯品过硼酸钠晶体中各元素的物质的量比为:n(Na):n(B):n(H):n(O)=1:1:n:7.将制得的纯品样品在
70℃以上加热将逐步失去结晶水,测得纯品质量随温度的变化如右图所示,则T3时所得晶体的化学式为

(4)若反应温度控制不当,所得的过硼酸钠晶体中将混有NaBO2,则产品中钠的质量分数
 2009年10月15日新华社报道:全国农村应当在“绿色生态-美丽多彩-低碳节能-循环发展”的理念引导下,更快更好地发展“中国绿色村庄”,参与“亚太国际低碳农庄”建设.可见“低碳循环”已经引起了国民的重视,试回答下列问题:
2009年10月15日新华社报道:全国农村应当在“绿色生态-美丽多彩-低碳节能-循环发展”的理念引导下,更快更好地发展“中国绿色村庄”,参与“亚太国际低碳农庄”建设.可见“低碳循环”已经引起了国民的重视,试回答下列问题:(1)煤的汽化和液化可以提高燃料的利用率.
已知25℃,101kPa时:C(s)+1/2O2(g)=CO(g)△H=-126.4kJ?mol-1
2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ?mol-1
H2O(g)=H2O(l)△H=-44kJ?mol-1
则在25℃,101kPa时:C(s)+H2O(g)=CO(g)+H2(g)△H=
(2)高炉炼铁是CO气体的重要用途之一,其基本反应为:
FeO(s)+CO(g) Fe(s)+CO2(g)△H>0,已知在1100℃时,该反应的化学平衡常数K=0.263.
①温度升高,化学平衡移动后达到新的平衡,此时平衡常数K值
②1100℃时测得高炉中,c(CO2)=0.025mol?L-1,c(CO)=0.1mol?L-1,则在这种情况下,该反应是否处于化学平衡状态
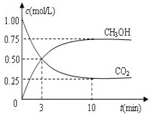
(3)目前工业上可用CO2来生产燃料甲醇,有关反应为:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ?mol-1.现向体积为1L的密闭容器中,充入1mol CO2和3mol H2,反应过程中测得CO2和CH3OH(g)的浓度随时间的变化如图所示.
①从反应开始到平衡,氢气的平均反应速率v(H2)=
②下列措施能使
| c(CH3OH) | c(CO2) |
A.升高温度 B.再充入H2 C.再充入CO2
D.将H2O(g)从体系中分离 E.充入He(g),使体系压强增大.
(2)室温下,pH=1的稀硫酸a L与pH=12的苛性钠b L混合后溶液的pH=2,忽略溶液混合前后体积变化,则a:b=
(3)已知25℃时100g水中溶有0.74g的Ca(OH)2即达到饱和,则该条件下Ca(OH)2离子积为Ksp=
(1)煤的汽化和液化可以提高燃料的利用率.
已知25℃,101kPa时:C(s)+1/2O2(g)=CO(g)△H=-126.4kJ?mol-1
2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ?mol-1
H2O(g)=H2O(l)△H=-44kJ?mol-1
则在25℃,101kPa时:C(s)+H2O(g)=CO(g)+H2(g)△H=______.
(2)高炉炼铁是CO气体的重要用途之一,其基本反应为:
FeO(s)+CO(g) Fe(s)+CO2(g)△H>0,已知在1100℃时,该反应的化学平衡常数K=0.263.
①温度升高,化学平衡移动后达到新的平衡,此时平衡常数K值______(填“增大”、“减小”或“不变”);
②1100℃时测得高炉中,c(CO2)=0.025mol?L-1,c(CO)=0.1mol?L-1,则在这种情况下,该反应是否处于化学平衡状态______(填“是”或“否”),其判断依据是______.
(3)目前工业上可用CO2来生产燃料甲醇,有关反应为:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ?mol-1.现向体积为1L的密闭容器中,充入1mol CO2和3mol H2,反应过程中测得CO2和CH3OH(g)的浓度随时间的变化如图所示.
①从反应开始到平衡,氢气的平均反应速率v(H2)=______;
②下列措施能使
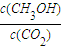 增大的是______(填符号).
增大的是______(填符号).A.升高温度 B.再充入H2 C.再充入CO2
D.将H2O(g)从体系中分离 E.充入He(g),使体系压强增大.
 查看习题详情和答案>>
查看习题详情和答案>>
新华社2009年10月15日报道:全国农村应当在“绿色生态—美丽多彩—低碳节能—循环发展”的理念引导下,更好更快地发展“中国绿色村庄”,参与“亚太国际低碳农庄”建设。可见“低碳循环”已经引起了国民的重视,试回答下列问题:
(1)煤的气化和液化可以提高燃料的利用率。
已知25℃,101kPa时:C(s)+![]()

则在25℃,101kPa时:C(s)+H2O(g)=CO(g)+H2(g)△H= 。
(2)高炉炼铁是CO气体的重要用途之一,其基本反应为:
FeO(s)+CO(g) ![]() Fe(s)+CO2(g)△H>0,已知在1100℃时,该反应的化学平衡常数K=0.263。
Fe(s)+CO2(g)△H>0,已知在1100℃时,该反应的化学平衡常数K=0.263。
①温度升高,化学平衡移动后达到新的平衡,此时平衡常数K的值 (填“增大”、“减小”或“不变”)
②1100℃时测得高炉中,c(CO2)=0.025mol·L-1,c(CO)=0.1mol·L-1,则在这种情况下,该反应是否处于化学平衡状态? (填“是”或“否”),其判断依据是
。
(3)目前工业上可用CO2来生产燃料甲醇,有关反应为:
CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g)△H=—49.0kJ·mol-1。现向体积为1L的密闭容器中,充入1molCO2和3molH2,反应过程中测得CO2和CH3OH(g)的浓度随时间的变化如图所示。
CH3OH(g)+H2O(g)△H=—49.0kJ·mol-1。现向体积为1L的密闭容器中,充入1molCO2和3molH2,反应过程中测得CO2和CH3OH(g)的浓度随时间的变化如图所示。
|
①从反应开始到平衡,氢气的平均反应速率v(H2)= ;
②下列措施能使![]() 增大的是 (填符号)。
增大的是 (填符号)。
A.升高温度 B.再充入H2
C.再充入CO2 D.将H2O(g)从体系中分离
E.充入He(g),使体系压强增大
查看习题详情和答案>>