题目内容
 2009年10月15日新华社报道:全国农村应当在“绿色生态-美丽多彩-低碳节能-循环发展”的理念引导下,更快更好地发展“中国绿色村庄”,参与“亚太国际低碳农庄”建设.可见“低碳循环”已经引起了国民的重视,试回答下列问题:
2009年10月15日新华社报道:全国农村应当在“绿色生态-美丽多彩-低碳节能-循环发展”的理念引导下,更快更好地发展“中国绿色村庄”,参与“亚太国际低碳农庄”建设.可见“低碳循环”已经引起了国民的重视,试回答下列问题:(1)煤的汽化和液化可以提高燃料的利用率.
已知25℃,101kPa时:C(s)+1/2O2(g)=CO(g)△H=-126.4kJ?mol-1
2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ?mol-1
H2O(g)=H2O(l)△H=-44kJ?mol-1
则在25℃,101kPa时:C(s)+H2O(g)=CO(g)+H2(g)△H=
(2)高炉炼铁是CO气体的重要用途之一,其基本反应为:
FeO(s)+CO(g) Fe(s)+CO2(g)△H>0,已知在1100℃时,该反应的化学平衡常数K=0.263.
①温度升高,化学平衡移动后达到新的平衡,此时平衡常数K值
②1100℃时测得高炉中,c(CO2)=0.025mol?L-1,c(CO)=0.1mol?L-1,则在这种情况下,该反应是否处于化学平衡状态
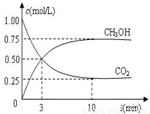
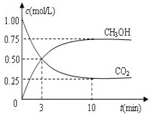
(3)目前工业上可用CO2来生产燃料甲醇,有关反应为:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ?mol-1.现向体积为1L的密闭容器中,充入1mol CO2和3mol H2,反应过程中测得CO2和CH3OH(g)的浓度随时间的变化如图所示.
①从反应开始到平衡,氢气的平均反应速率v(H2)=
②下列措施能使
| c(CH3OH) | c(CO2) |
A.升高温度 B.再充入H2 C.再充入CO2
D.将H2O(g)从体系中分离 E.充入He(g),使体系压强增大.
(2)①反应是吸热反应,温度升高平衡正向进行,平衡常数增大;
②依据浓度商和平衡常数比较判断平衡移动的方向;
(3)①依据图象分析,达到平衡时物质的浓度变化,结合反应速率概念计算得到;
②CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ?mol-1.依据平衡移动方向分析判断
| c(CH3OH) |
| c(CO2) |
A.升高温度平衡逆向进行,
| c(CH3OH) |
| c(CO2) |
B.再充入H2 平衡正向进行,
| c(CH3OH) |
| c(CO2) |
C.再充入CO2 平衡正向进行,
| c(CH3OH) |
| c(CO2) |
D.将H2O(g)从体系中分离平衡正向进行,
| c(CH3OH) |
| c(CO2) |
E.充入He(g),使体系压强增大,分压不变,平衡不动,
| c(CH3OH) |
| c(CO2) |
②2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ?mol-1
③H2O(g)=H2O(l)△H=-44kJ?mol-1
依据盖斯定律①-
| ② |
| 2 |
则在25℃,101kPa时:C(s)+H2O(g)=CO(g)+H2(g)△H=115.4 kJ?mol-1;
故答案为:115.4 kJ?mol-1;
(2)①FeO(s)+CO(g)=Fe(s)+CO2(g)△H>0,温度升高,化学平衡移动后达到新的平衡,平衡正向进行,平衡常数增大,故答案为:增大;
②1100℃时测得高炉中,c(CO2)=0.025mol?L-1,c(CO)=0.1mol?L-1,则在这种情况下,Qc=
| c(CO2) |
| c(CO) |
| 0.025mol/L |
| 0.1mol/L |
| c(CO2) |
| c(CO) |
(3)①CO2(g)+3H2(g)?CH3OH(g)+H2O(g),依据图象分析达到平衡后,c(CH3OH)=0.75mol/L,c(CO2)=0.25mol/L,反应消耗的氢气浓度c(H2)=2.25mol/L,氢气的平均反应速率v(H2)=
| 2.25mol/L |
| 10min |
②CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ?mol-1.依据平衡移动方向分析判断
| c(CH3OH) |
| c(CO2) |
A.升高温度平衡逆向进行,
| c(CH3OH) |
| c(CO2) |
B.再充入H2 平衡正向进行,
| c(CH3OH) |
| c(CO2) |
C.再充入CO2 平衡正向进行,
| c(CH3OH) |
| c(CO2) |
D.将H2O(g)从体系中分离平衡正向进行,
| c(CH3OH) |
| c(CO2) |
E.充入He(g),使体系压强增大,分压不变,平衡不动,
| c(CH3OH) |
| c(CO2) |
故答案为:BD.

 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案新华社2009年10月15日报道:全国农村应当在“绿色生态—美丽多彩—低碳节能—循环发展”的理念引导下,更好更快地发展“中国绿色村庄”,参与“亚太国际低碳农庄”建设。可见“低碳循环”已经引起了国民的重视,试回答下列问题:
(1)煤的气化和液化可以提高燃料的利用率。
已知25℃,101kPa时:C(s)+![]()

则在25℃,101kPa时:C(s)+H2O(g)=CO(g)+H2(g)△H= 。
(2)高炉炼铁是CO气体的重要用途之一,其基本反应为:
FeO(s)+CO(g) ![]() Fe(s)+CO2(g)△H>0,已知在1100℃时,该反应的化学平衡常数K=0.263。
Fe(s)+CO2(g)△H>0,已知在1100℃时,该反应的化学平衡常数K=0.263。
①温度升高,化学平衡移动后达到新的平衡,此时平衡常数K的值 (填“增大”、“减小”或“不变”)
②1100℃时测得高炉中,c(CO2)=0.025mol·L-1,c(CO)=0.1mol·L-1,则在这种情况下,该反应是否处于化学平衡状态? (填“是”或“否”),其判断依据是
。
(3)目前工业上可用CO2来生产燃料甲醇,有关反应为:
CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g)△H=—49.0kJ·mol-1。现向体积为1L的密闭容器中,充入1molCO2和3molH2,反应过程中测得CO2和CH3OH(g)的浓度随时间的变化如图所示。
CH3OH(g)+H2O(g)△H=—49.0kJ·mol-1。现向体积为1L的密闭容器中,充入1molCO2和3molH2,反应过程中测得CO2和CH3OH(g)的浓度随时间的变化如图所示。
|
①从反应开始到平衡,氢气的平均反应速率v(H2)= ;
②下列措施能使![]() 增大的是 (填符号)。
增大的是 (填符号)。
A.升高温度 B.再充入H2
C.再充入CO2 D.将H2O(g)从体系中分离
E.充入He(g),使体系压强增大

 CH3OH(g)+H2O(g)△H=-(n-m)kJ?mol-1
CH3OH(g)+H2O(g)△H=-(n-m)kJ?mol-1
 CH3CH2OH(g)+3H2O(g) 25℃时,K=2.95×1011
CH3CH2OH(g)+3H2O(g) 25℃时,K=2.95×1011
 ①温度升高,K值
①温度升高,K值
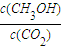 增大的是______(填符号).
增大的是______(填符号).