摘要:21].将200g浓度为3.65%的稀盐酸加入到80g浓度为10%的NaOH溶液里恰好完全反应.(已知20℃时NaCl的溶解度为36g)试求: (1)反应后溶液中水的质量 (2)若将反应后所得溶液制成20℃时的饱和溶液.需蒸发掉多少克水? [22].已知同温同压下.相同体积的不同气体中含有相同数目的分子.右图是一定体积的氢气和不同体积的氧气合成水的实验数据的关系图(横坐标表示反应前氧气的体积.纵坐标表示反应后剩余气体的体积.气体体积均在同温同压下测定).试回答: (1)实线部分表示剩余的气体是 , (2)虚线部分表示剩余的气体是 , (3)实线与虚线的交点P表示的意义是 , (4)反应前原有氢气 mL.
网址:http://m.1010jiajiao.com/timu3_id_345547[举报]
钛被称为继铁、铝之后的第三金属,也有人说“21世纪将是钛的世纪”.
(1)二氧化钛在现代社会里有广泛的用途,它的产量是一个国家国民经济发展程度的标志.我国至今产量不足,尚需进口二氧化钛.“硫酸法”生产二氧化钛的原料是钛铁矿(主要成分是:FeTiO3,还含有少量Mn、Zn、Cr、Cu等重金属元素及脉石等杂质),主要生产流程是:
①将钛铁矿与浓H2SO4煮解:FeTiO3+2H2SO4(浓)===TiOSO4+FeSO4+2H2O(硫酸钛酰)
②加水分解硫酸氧钛:TiOSO4+(n+1)H2O===TiO2·nH2O+H2SO4
③
煅烧TiO2·nH2O“硫酸法”生产TiO2排放的废液对水体有哪些污染,请指出主要的二点:
①________;
②________.
根据废液主要成分,针对其中一项污染,提出处理的方法.③________
(2)某化学兴趣小组对Mg、Ti、Cu三种金属的金属活动性顺序进行探究.
提出假设:a.Ti金属活动性比Mg强;b.Ti金属活动性比Cu弱.
查阅资料:在相同条件下,金属与酸反应产生气泡的速度快,则该金属活动性越强.
实验设计:同温下,取大小相同的这三种金属薄片,用砂布将表面擦光亮,分别投入等体积等浓度的足量稀盐酸和稀HF溶液中反应,观察现象.
①稀盐酸:放出H2速率Mg>Ti,铜不反应.②稀HF:放出H2速率Ti>Mg
根据上述________现象(填①或②)得出金属活动性Mg________Ti.如何解释另一反常现象________.
含硫化合物的种类很多,现有H2SO4、H2SO3、SO2、Na2SO3、BaSO4、CuSO4、Na2SO4这7种常见的含硫化合物.回答下列问题:
(1)H2SO3转化为硫酸是酸雨形成的重要过程之一,写出其反应的化学方程式,并标明电子转移方向和数目:
 .
.
(2)Ba2+有剧毒.某市曾发生一起“毒烧饼”事件,起因是烧饼摊主在制作烧饼的过程中误将碳酸钡当作干粉使用,导致多人食用烧饼后中毒.试写出碳酸钡与胃酸(以盐酸表示)反应的离子反应方程式
(3)常温下,将铁棒置于浓硫酸中,无明显现象,课本上解释为发生了钝化,但有人认为未发生反应.为验证此过程,某同学经过思考,设计了如下实验:将经浓硫酸处理过的铁棒洗净后置于CuSO4溶液中,若铁棒表面
(4)用Na2SO3吸收法作为治理SO2污染的一种方法,其原理为(用化学方程式表示):
(5)减少SO2的污染并变废为宝,我国正在探索在一定条件下用CO还原SO2得到单质硫的方法来除去SO2.该反应的化学方程式:
(6)制取硫酸铜有两种方法:方法一:2Cu+O2
2CuO,CuO+H2SO4═CuSO4+H2O,
方法二:Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O,方法一与方法二相比,其优点是:
查看习题详情和答案>>
(1)H2SO3转化为硫酸是酸雨形成的重要过程之一,写出其反应的化学方程式,并标明电子转移方向和数目:


(2)Ba2+有剧毒.某市曾发生一起“毒烧饼”事件,起因是烧饼摊主在制作烧饼的过程中误将碳酸钡当作干粉使用,导致多人食用烧饼后中毒.试写出碳酸钡与胃酸(以盐酸表示)反应的离子反应方程式
BaCO3+2HCl=BaCl2+CO2↑+H2O
BaCO3+2HCl=BaCl2+CO2↑+H2O
.(3)常温下,将铁棒置于浓硫酸中,无明显现象,课本上解释为发生了钝化,但有人认为未发生反应.为验证此过程,某同学经过思考,设计了如下实验:将经浓硫酸处理过的铁棒洗净后置于CuSO4溶液中,若铁棒表面
无明显现象
无明显现象
,则发生了钝化;若铁棒表面有紫红色物质析出
有紫红色物质析出
,则未发生反应.(4)用Na2SO3吸收法作为治理SO2污染的一种方法,其原理为(用化学方程式表示):
Na2SO3+SO2+H2O=2NaHSO3
Na2SO3+SO2+H2O=2NaHSO3
.(5)减少SO2的污染并变废为宝,我国正在探索在一定条件下用CO还原SO2得到单质硫的方法来除去SO2.该反应的化学方程式:
SO2+2CO
S+2CO2
| ||
SO2+2CO
S+2CO2
.
| ||
(6)制取硫酸铜有两种方法:方法一:2Cu+O2
| ||
方法二:Cu+2H2SO4(浓)
| ||
节省原料(硫酸用量少)、无污染
节省原料(硫酸用量少)、无污染
(答任一点).
某学习兴趣小组探究废干电池(锌筒内填有炭粉、MnO2、NH4Cl等的糊状物)的回收利用,并用回收的物质进行如下实验.
I.(1)从废干电池中提取NH4Cl.
①利用该糊状物提取NH4Cl前两步的操作为:a.溶解 b. .
②甲同学设想:将分离出的NH4Cl溶液蒸发、结晶、灼烧,就可以制得纯净的NH4Cl.
请对甲同学的方案作出评价并说明理由: .
(2)制取氨气.
①乙同学要制备并收集到纯净的氨气,下列各反应及操作中合理的是
a.将氯化铵固体加热分解 b.将浓氨水滴入氢氧化钠固体中
c.将氢氧化钠固体加入浓氨水中 d.将氯化铵浓溶液滴入氢氧化钠固体中
②乙同学认为将集气瓶正放在桌上(如图1所示),就可以收集到纯净的氨气.
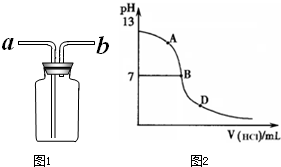
你若认为可行,请说明其操作: .
你若认为不可行,请说明其理由: .
Ⅱ.丙同学利用上面得到的氨气制取氨水并进行了如下探究实验:
(3)为探究NH3?H2O是否是弱电解质.
丙该同学设计方案如下:①将1.12L(标况)NH3完全溶于水,配得溶液500mL;② ;③分析数据,即可得出结论.
请把最简单的实验步骤②,填写在上面的空格中.
(4)探究氨水与盐酸的反应过程.
丙同学进行了如下实验:向25mL上述氨水中逐滴滴加同浓度的盐酸,测定反应过程中溶液pH并绘制其pH变化曲线(如图2).请回答:
①酸碱恰好完全中和时的pH点应是 (填A或B或D),②此时溶液中c(NH3?H2O)+c(NH4+)= mol?L-1,③溶液中各离子的浓度由大到小的顺序为 .
查看习题详情和答案>>
I.(1)从废干电池中提取NH4Cl.
①利用该糊状物提取NH4Cl前两步的操作为:a.溶解 b.
②甲同学设想:将分离出的NH4Cl溶液蒸发、结晶、灼烧,就可以制得纯净的NH4Cl.
请对甲同学的方案作出评价并说明理由:
(2)制取氨气.
①乙同学要制备并收集到纯净的氨气,下列各反应及操作中合理的是
a.将氯化铵固体加热分解 b.将浓氨水滴入氢氧化钠固体中
c.将氢氧化钠固体加入浓氨水中 d.将氯化铵浓溶液滴入氢氧化钠固体中
②乙同学认为将集气瓶正放在桌上(如图1所示),就可以收集到纯净的氨气.

你若认为可行,请说明其操作:
你若认为不可行,请说明其理由:
Ⅱ.丙同学利用上面得到的氨气制取氨水并进行了如下探究实验:
(3)为探究NH3?H2O是否是弱电解质.
丙该同学设计方案如下:①将1.12L(标况)NH3完全溶于水,配得溶液500mL;②
请把最简单的实验步骤②,填写在上面的空格中.
(4)探究氨水与盐酸的反应过程.
丙同学进行了如下实验:向25mL上述氨水中逐滴滴加同浓度的盐酸,测定反应过程中溶液pH并绘制其pH变化曲线(如图2).请回答:
①酸碱恰好完全中和时的pH点应是
含硫化合物的种类很多,现有H2SO4、H2SO3、SO2、Na2SO3、BaSO4、CuSO4、Na2SO4这7种常见的含硫化合物.回答下列问题:
(1)H2SO3转化为硫酸是酸雨形成的重要过程之一,写出其反应的化学方程式: .
(2)Ba2+有剧毒.我市曾发生一起“毒烧饼”事件,起因是烧饼摊主在制作烧饼的过程中误将有毒化工原料碳酸钡当作干粉使用,导致多人中毒.试用化学方程式说明“毒烧饼”事件中的中毒原因 (用化学方程式表示).患者被送往医院后,
医生往往让其服用 (填题干所列7种物质中的一种)来解毒.
(3)常温下,将铁棒置于浓硫酸中,无明显现象,课本上解释为发生了钝化,但有人认为未发生反应.为验证此过程,某同学经过思考,设计了如下实验:将经浓硫酸处理过的铁棒洗净后置于CuSO4溶液中,若铁棒表面 ,则发生了钝化;若铁棒表面 ,则未发生反应.
(4)美国和日本正在研究用Na2SO3吸收法作为治理SO2污染的一种新方法,其原理为(用化学方程式表示): .
(5)为进一步减少SO2的污染并变废为宝,我国正在探索在一定条件下用CO还原SO2得到单质硫的方法来除去SO2.写出该反应的化学方程式: .
(6)制取硫酸铜的方法有两种:
方法一:2Cu+O2
2CuO,CuO+H2SO4=CuSO4+H2O
方法二:Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O
方法一与方法二相比,其优点是: .
(7)硅是无机非金属材料的主角.请你举出两种含硅的材料名称 、 .
(8)大量使用化石燃料,最直接的危害是造成大气污染,如“温室效应”、“酸雨”等都与大量使用化石燃料有关.为了防治酸雨,降低煤燃烧时向大气排放的SO2,工业上将生石灰和含硫煤混合后使用.请写出燃烧时,有关“固硫”(不使硫的化合物进入大气)反应的化学方程式 , ;
(9)生活中处处有化学,缺铁性贫血患者应补充Fe2+,通常以硫酸亚铁的形式,而硫酸铁则无这种药效.当用硫酸亚铁制成药片时外表包有一层特殊的糖衣,这层糖衣的作用是 如果药片已经失效,应如何检验?写出主要操作与现象 .
查看习题详情和答案>>
(1)H2SO3转化为硫酸是酸雨形成的重要过程之一,写出其反应的化学方程式:
(2)Ba2+有剧毒.我市曾发生一起“毒烧饼”事件,起因是烧饼摊主在制作烧饼的过程中误将有毒化工原料碳酸钡当作干粉使用,导致多人中毒.试用化学方程式说明“毒烧饼”事件中的中毒原因
医生往往让其服用
(3)常温下,将铁棒置于浓硫酸中,无明显现象,课本上解释为发生了钝化,但有人认为未发生反应.为验证此过程,某同学经过思考,设计了如下实验:将经浓硫酸处理过的铁棒洗净后置于CuSO4溶液中,若铁棒表面
(4)美国和日本正在研究用Na2SO3吸收法作为治理SO2污染的一种新方法,其原理为(用化学方程式表示):
(5)为进一步减少SO2的污染并变废为宝,我国正在探索在一定条件下用CO还原SO2得到单质硫的方法来除去SO2.写出该反应的化学方程式:
(6)制取硫酸铜的方法有两种:
方法一:2Cu+O2
| ||
方法二:Cu+2H2SO4(浓)
| ||
方法一与方法二相比,其优点是:
(7)硅是无机非金属材料的主角.请你举出两种含硅的材料名称
(8)大量使用化石燃料,最直接的危害是造成大气污染,如“温室效应”、“酸雨”等都与大量使用化石燃料有关.为了防治酸雨,降低煤燃烧时向大气排放的SO2,工业上将生石灰和含硫煤混合后使用.请写出燃烧时,有关“固硫”(不使硫的化合物进入大气)反应的化学方程式
(9)生活中处处有化学,缺铁性贫血患者应补充Fe2+,通常以硫酸亚铁的形式,而硫酸铁则无这种药效.当用硫酸亚铁制成药片时外表包有一层特殊的糖衣,这层糖衣的作用是
21世纪将是人类开发海洋的世纪.海水资源丰富可以为人类解决多方面的资源危机,海洋化学资源可以为人类提供丰富的化工原料.海水中含量最多的金属离子是( )
| A、钠离子 | B、氯离子 | C、钙离子 | D、镁离子 |