摘要:10.配制100ml 1mol·l-1氯化钠溶液.下列操作中错误的是 ( ) A.在托盘天平上放两片大小一样的纸.然后将氯化钠放在纸片上称量 B.把称得的氯化钠放入盛有适量蒸馏水的烧杯中.溶解.冷却.再把溶液移入容量瓶中C.用蒸馏水洗涤烧杯.玻璃棒2-3次.洗涤液也移入容量瓶中 D.沿玻璃棒往容量瓶中加入蒸馏水.直到溶液凹面恰好与刻度线相切
网址:http://m.1010jiajiao.com/timu3_id_345389[举报]
用98%的浓硫酸(其密度为1.84g/cm3)配制100mL 1.0mol?L-1稀硫酸,
(1)经计算,应用
(2)配制操作可分解成如下几步,以下正确的操作顺序是
A.向容量瓶中注入少量蒸馏水,检查是否漏水
B.用少量蒸馏水洗涤烧杯及玻璃棒,将溶液注入容量瓶,并重复操作两次
C.用已冷却的稀硫酸注入已检查不漏水的容量瓶中D.根据计算,用量筒量取一定体积的浓硫酸
E.将浓硫酸沿烧杯壁慢慢注入盛有蒸馏水的小烧杯中,并不断用玻璃棒搅拌
F.盖上容量瓶塞子,振荡,摇匀
G.用胶头滴管滴加蒸馏水,使溶液凹面恰好与刻度相切
H.继续往容量瓶中小心地加蒸馏水,使液面接近刻度线1~2cm
(3)所需仪器除烧杯、玻璃棒、量筒外还需
(4)玻璃棒在整个实验中的作用是
(5)由于错误操作,使得到的浓度数据比正确的偏大的是
A.使用容量瓶配制溶液时,俯视液面定容后所得溶液的浓度
B.没有用蒸馏水洗烧杯2-3次,并将洗液移入容量瓶中
C.容量瓶用蒸馏水洗净,没有烘干
D.定容时,滴加蒸馏水,先使液面略高于刻度线,再吸出少量水使液面凹面与刻度线相切
E.把配好的溶液倒入用蒸馏水洗净而末干的试剂瓶中备用.
查看习题详情和答案>>
(1)经计算,应用
10mL量筒
10mL量筒
(填仪器名称及规格,下同)取浓硫酸5.4mL
5.4mL
.(2)配制操作可分解成如下几步,以下正确的操作顺序是
ADECBHGF
ADECBHGF
A.向容量瓶中注入少量蒸馏水,检查是否漏水
B.用少量蒸馏水洗涤烧杯及玻璃棒,将溶液注入容量瓶,并重复操作两次
C.用已冷却的稀硫酸注入已检查不漏水的容量瓶中D.根据计算,用量筒量取一定体积的浓硫酸
E.将浓硫酸沿烧杯壁慢慢注入盛有蒸馏水的小烧杯中,并不断用玻璃棒搅拌
F.盖上容量瓶塞子,振荡,摇匀
G.用胶头滴管滴加蒸馏水,使溶液凹面恰好与刻度相切
H.继续往容量瓶中小心地加蒸馏水,使液面接近刻度线1~2cm
(3)所需仪器除烧杯、玻璃棒、量筒外还需
100mL容量瓶
100mL容量瓶
、胶头滴管
胶头滴管
.(4)玻璃棒在整个实验中的作用是
搅拌、引流
搅拌、引流
.(5)由于错误操作,使得到的浓度数据比正确的偏大的是
A
A
(填写序号).A.使用容量瓶配制溶液时,俯视液面定容后所得溶液的浓度
B.没有用蒸馏水洗烧杯2-3次,并将洗液移入容量瓶中
C.容量瓶用蒸馏水洗净,没有烘干
D.定容时,滴加蒸馏水,先使液面略高于刻度线,再吸出少量水使液面凹面与刻度线相切
E.把配好的溶液倒入用蒸馏水洗净而末干的试剂瓶中备用.
实验室要配制100mL 0.1mol?L-1的NaCl溶液,试回答下列各题:
(1)下列仪器中,一定不会用到的是
A.锥形瓶 B.200mL容量瓶 C.量筒 D.胶头滴管 E.100mL容量瓶 F.托盘天平 G、烧杯
(2)若要实施配制,除上述仪器外,尚缺的仪器或用品是
(3)容量瓶上除有刻度线、容积外还应标有
(4)溶液配制过程主要包括如图各步骤:其正确的操作顺序应是
(5)配制完毕后,教师指出有四位同学各进行了下列某一项错误操作,你认为这四项错误操作会导致所得溶液浓度偏高的是
A.定容时仰视容量瓶刻度线 B.定容时俯视容量瓶刻度线
C.将溶解冷却的溶液转入容量瓶后未洗涤就直接转入定容操作
D.定容后,把容量瓶倒置摇匀后发现液面低于刻度线,便补充几滴水至刻度处
(6)通过计算可得出可用托盘天平称取NaCl固体

查看习题详情和答案>>
(1)下列仪器中,一定不会用到的是
AB
AB
A.锥形瓶 B.200mL容量瓶 C.量筒 D.胶头滴管 E.100mL容量瓶 F.托盘天平 G、烧杯
(2)若要实施配制,除上述仪器外,尚缺的仪器或用品是
钥匙和玻璃棒
钥匙和玻璃棒
.(3)容量瓶上除有刻度线、容积外还应标有
温度
温度
,在使用前必须检查容量瓶是否完好以及瓶塞
瓶塞
处是否漏水.(填容量瓶的受检部位)(4)溶液配制过程主要包括如图各步骤:其正确的操作顺序应是
DCBFAE
DCBFAE
(填各步骤序号).(5)配制完毕后,教师指出有四位同学各进行了下列某一项错误操作,你认为这四项错误操作会导致所得溶液浓度偏高的是
B
B
A.定容时仰视容量瓶刻度线 B.定容时俯视容量瓶刻度线
C.将溶解冷却的溶液转入容量瓶后未洗涤就直接转入定容操作
D.定容后,把容量瓶倒置摇匀后发现液面低于刻度线,便补充几滴水至刻度处
(6)通过计算可得出可用托盘天平称取NaCl固体
0.6
0.6
克.若用4mol/L的NaCl溶液配制应用量筒量取2.5
2.5
mL该溶液.
完成下列实验所选择的装置或仪器 (夹持装置己略去)正确的是( )
| A | B | C | D | |
| 实验 | 用CCl4提取碘水中的I2 | 分离乙醇中的I2 | 加热分解 MgCl26H2O得到 纯净的MgCl2 |
配制100mL 10.1000mol/L K2Cr2O7溶液 |
| 装置或仪器 | 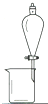 |
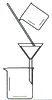 |
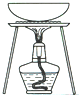 |
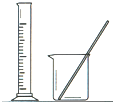 |
| A、A | B、B | C、C | D、D |
(2012?南京模拟)实验室用硫酸铵、硫酸和废铁屑制备硫酸亚铁铵晶体的方法如下:
步骤1:将废铁屑依次用热的碳酸钠溶液、蒸馏水洗涤.
步骤2:向盛有洁净铁屑的烧杯中加入稀H2SO4溶液,水浴加热,使铁屑与稀硫酸反应至基本不再冒出气泡为止.趁热过滤.
步骤3:向滤液中加入一定量的(NH4)2SO4固体.
表1 硫酸亚铁晶体、硫酸铵、硫酸亚铁铵晶体的溶解度(g/100g H2O)
(1)步骤2中控制生成的硫酸亚铁中不含硫酸铁的方法是
(2)在0~60℃范围内,从硫酸亚铁和硫酸铵的混合溶液中可获得硫酸亚铁铵晶体的原因是
(3)为了从步骤3所得溶液中获得硫酸亚铁铵晶体,操作是
(4)测定硫酸亚铁铵晶体中Fe2+含量的步骤如下:
步骤1:准确称取硫酸亚铁铵晶体样品a g(约为0.5g),并配制成100mL溶液;
步骤2:准确移取25.0mL硫酸亚铁铵溶液于250mL锥形瓶中;
步骤3:立即用浓度约为0.1mol?L-1KMnO4溶液滴定至溶液呈稳定的粉红色,即为终点;
步骤4:将实验步骤1~3重复2次.
①步骤1中配制100mL溶液需要的玻璃仪器是
②为获得样品中Fe2+的含量,还需补充的实验是
查看习题详情和答案>>
步骤1:将废铁屑依次用热的碳酸钠溶液、蒸馏水洗涤.
步骤2:向盛有洁净铁屑的烧杯中加入稀H2SO4溶液,水浴加热,使铁屑与稀硫酸反应至基本不再冒出气泡为止.趁热过滤.
步骤3:向滤液中加入一定量的(NH4)2SO4固体.
表1 硫酸亚铁晶体、硫酸铵、硫酸亚铁铵晶体的溶解度(g/100g H2O)
| 物质 | 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | 60℃ |
| FeSO4?7H2O | 15.6 | 20.5 | 26.5 | 32.9 | 40.2 | 48.6 | - |
| (NH4)2SO4 | 70.6 | 73.0 | 75.4 | 78.0 | 81.0 | - | 88.0 |
| (NH4)2SO4?FeSO4?6H2O | 12.5 | 17.2 | 21.0 | 28.1 | 33.0 | 40.0 | 44.6 |
保持铁过量
保持铁过量
.(2)在0~60℃范围内,从硫酸亚铁和硫酸铵的混合溶液中可获得硫酸亚铁铵晶体的原因是
在0~60℃范围内,同一温度下硫酸亚铁铵晶体的溶解度最小
在0~60℃范围内,同一温度下硫酸亚铁铵晶体的溶解度最小
.(3)为了从步骤3所得溶液中获得硫酸亚铁铵晶体,操作是
蒸发浓缩,冷却结晶,过滤、冰水洗涤,干燥
蒸发浓缩,冷却结晶,过滤、冰水洗涤,干燥
.(4)测定硫酸亚铁铵晶体中Fe2+含量的步骤如下:
步骤1:准确称取硫酸亚铁铵晶体样品a g(约为0.5g),并配制成100mL溶液;
步骤2:准确移取25.0mL硫酸亚铁铵溶液于250mL锥形瓶中;
步骤3:立即用浓度约为0.1mol?L-1KMnO4溶液滴定至溶液呈稳定的粉红色,即为终点;
步骤4:将实验步骤1~3重复2次.
①步骤1中配制100mL溶液需要的玻璃仪器是
玻璃棒、100mL容量瓶、胶头滴管、烧杯
玻璃棒、100mL容量瓶、胶头滴管、烧杯
.②为获得样品中Fe2+的含量,还需补充的实验是
准确测定滴定中消耗的高锰酸钾溶液的体积
准确测定滴定中消耗的高锰酸钾溶液的体积
.(1)用18.0mol/L H2SO4配制100mL 1.00mol/L H2SO4,则需要的实验仪器除了烧杯、玻璃棒、胶头滴管以外还应该有:
配制过程中,下列情况会使配制结果偏高的是(填序号)
①定容是俯视刻度线观察液面
②容量瓶使用时未干燥
③定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度
④容量瓶盛过H2SO4溶液,使用前未洗涤
(2)在容量瓶使用方法中,下列操作不正确的是(填字母)
A.使用容量瓶前检查它是否漏水
B.容量瓶用蒸馏水洗净后,再用待配液润洗
C.配制溶液时,如果试样是液体,用量筒量取试样后直接倒入容量瓶中,缓慢加入蒸馏水到接近标线1~2cm处,再改用胶头滴管加蒸馏水到刻度线
D.盖好瓶塞,用食指顶住瓶塞,用另一只手托住瓶底,把容量瓶倒转摇匀.
查看习题详情和答案>>
100mL容量瓶、量筒
100mL容量瓶、量筒
配制过程中,下列情况会使配制结果偏高的是(填序号)
①④
①④
①定容是俯视刻度线观察液面
②容量瓶使用时未干燥
③定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度
④容量瓶盛过H2SO4溶液,使用前未洗涤
(2)在容量瓶使用方法中,下列操作不正确的是(填字母)
BC
BC
A.使用容量瓶前检查它是否漏水
B.容量瓶用蒸馏水洗净后,再用待配液润洗
C.配制溶液时,如果试样是液体,用量筒量取试样后直接倒入容量瓶中,缓慢加入蒸馏水到接近标线1~2cm处,再改用胶头滴管加蒸馏水到刻度线
D.盖好瓶塞,用食指顶住瓶塞,用另一只手托住瓶底,把容量瓶倒转摇匀.