摘要: 在下列各组物质中.全都是由分子构成的一组化合物是( ) (A) CO2, CH4, SiO2 (B) HNO3, C6H6, C12H22O11 (C) HO, H2O2, H2O (D) NH3, NH3·H2O, NH4Cl 10. 具有解热镇痛及抗生素作用的药物“芬必得 . 其主要成分的结构式如图 它属于( ) (A) 芳香族化合物 (B) 苯甲酸的同系物 (C) 易溶于水的有机物 (D) 易升华的物质
网址:http://m.1010jiajiao.com/timu3_id_34454[举报]
科学家们在探索生命奥秘的过程中,认识到生命细胞的组成和元素周期律有着密切的联系,约占人体总质量的99.97%的11种大量元素全部是元素周期表前20号元素,其余0.03%是由10多种人体不可缺少的微量元素组成.现有a~h 8种短周期元素,是除氧、钾、钙外的其他大量元素,它们在元素周期表中的位置如下,请据此回答下列问题:

(1)下列元素的原子间反应最容易形成离子键的是
A.c和f B.b和g C.d和g D.b和e
(2)下列由a~g形成的各分子中所有原子都满足最外层为8电子结构的是
A.ea3 B.ag C.fg3 D.dg4
(3)均由a、b、h和氧四种元素形成的两种离子化合物,相互反应可生成有刺激性气味的气体.这两种化合物中有一种式量为120,该化合物熔化时破坏的是
查看习题详情和答案>>

(1)下列元素的原子间反应最容易形成离子键的是
B
B
,容易形成共价键的是C
C
.A.c和f B.b和g C.d和g D.b和e
(2)下列由a~g形成的各分子中所有原子都满足最外层为8电子结构的是
C、D
C、D
.A.ea3 B.ag C.fg3 D.dg4
(3)均由a、b、h和氧四种元素形成的两种离子化合物,相互反应可生成有刺激性气味的气体.这两种化合物中有一种式量为120,该化合物熔化时破坏的是
离子键
离子键
(填化学键类型,下同),溶于水时破坏的是离子键和共价键
离子键和共价键
.
科学家们在探索生命奥秘的过程中,认识到生命细胞的组成和元素周期律有着密切的联系,约占人体总质量99.97%的11种大量元素全部位于元素周期表前20号元素,其余0.03%是由10多种人体不可缺少的微量元素组成.现有a~g 7种短周期元素,是除氧、硫、钾、钙外的其他大量元素,它们在元素周期表中的位置如下,请据此回答下列问题:
(1)元素的原子间反应最容易形成离子键的是下列中的______,元素的原子间反应容易形成共价键的是下列中的______A.c和f B.b和g C.d和g D.d和e
(2)下列由a~g形成的各分子中,所有原子都满足最外层为8电子结构的是______.
A.ea3 B.ag C.fg3 D.dg4
(3)由11种元素的几种非金属元素构成的离子化合物的电子式为______.
(4)c与e可形成一种化合物,试根据原子结构写出该化合物的化学式______,化学键类型为______,与稀盐酸反应的方程式为______.
查看习题详情和答案>>
| a | |||||||||||||||||
| d | e | ||||||||||||||||
| b | c | f | g | ||||||||||||||
(2)下列由a~g形成的各分子中,所有原子都满足最外层为8电子结构的是______.
A.ea3 B.ag C.fg3 D.dg4
(3)由11种元素的几种非金属元素构成的离子化合物的电子式为______.
(4)c与e可形成一种化合物,试根据原子结构写出该化合物的化学式______,化学键类型为______,与稀盐酸反应的方程式为______.
查看习题详情和答案>>
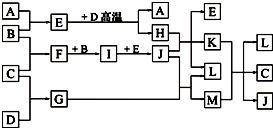 如图,常温下单质A、B为气体,单质C为固体,它们依次分别由短周期元素甲、乙、丙组成,甲元素原子核外电子数等于其电子层数,乙、丙同主族;E常温下为液体,G、H为黑色固体,D是常见金属(反应条件多数略去).
如图,常温下单质A、B为气体,单质C为固体,它们依次分别由短周期元素甲、乙、丙组成,甲元素原子核外电子数等于其电子层数,乙、丙同主族;E常温下为液体,G、H为黑色固体,D是常见金属(反应条件多数略去).回答下列问题:
(1)化合物E的沸点高于化合M的沸点,原因是
(2)甲、乙两种元素可以形成两种化合物,其中一种化合物含有4个原子核,该化合物的结构式为
(3)E与D高温反应的化学方程式为
(4)实验室在保存L溶液时,需加入少量D,理由是
(5)已知一定条件下,每1mol F与单质B完全反应生成I放出热量98.0kJ,若2mol F与1mol B在此条件下发生反应,达平衡时,放出热量为176.4kJ,则F的转化率为
①4mol F、2mol B ②2mol F、2mol B、2mol I
③1mol F、0.5mol B、1mol I ④3mol I、1mol Ne.
| |||||||||||||||
已知X是一种盐,H是一种古代劳动人民就已掌握冶炼技术的金属单质,F、P、J是常见的非金属单质,I、E、G都是工业上重要的碱性物质,P和J在一定条件下反应生成I.它们有如下的关系,试回答下列问题:

(1)G的化学式为
(2)写出下列反应的化学方程式:
①
②
(3)某课外小组同学设计了下列实验装置,通过测定某些装置中试剂的质量变化,进一步探究X中各元素的质量关系.
 ①为使数据准确,还需补充装置,请你在方框内绘出装置图并写出试剂名称;
①为使数据准确,还需补充装置,请你在方框内绘出装置图并写出试剂名称;
②向装置中鼓入空气的目的是
③如何判断X已完全分解?
④更精确的测定得出如下数据:X受热后完全分解,固体由16.52g变为12.00g,装置乙增重1.44g.写出X的化学式
请写出X与盐酸反应的化学方程式为:
(4)L是由3种元素构成的分子,能与I以1:2的物质的量之比反应生成尿素CO(NH2)2和物质M,其中M能使硝酸酸化的硝酸银溶液产生白色沉淀,写出L的电子式
 .
.
查看习题详情和答案>>

(1)G的化学式为
NaOH
NaOH
;(2)写出下列反应的化学方程式:
①
2Na2O2+2CO2=2Na2CO3+O2
2Na2O2+2CO2=2Na2CO3+O2
;②
2NH3+3CuO=N2+3Cu+3H2O
2NH3+3CuO=N2+3Cu+3H2O
;(3)某课外小组同学设计了下列实验装置,通过测定某些装置中试剂的质量变化,进一步探究X中各元素的质量关系.
 ①为使数据准确,还需补充装置,请你在方框内绘出装置图并写出试剂名称;
①为使数据准确,还需补充装置,请你在方框内绘出装置图并写出试剂名称;②向装置中鼓入空气的目的是
将X分解产生的水蒸气送入盛有浓硫酸的洗气瓶中
将X分解产生的水蒸气送入盛有浓硫酸的洗气瓶中
;丙装置中药品的名称为无水硫酸铜
无水硫酸铜
,实验时,该药品未见明显变化,证明X分解产生的水蒸气全部被浓硫酸吸收
X分解产生的水蒸气全部被浓硫酸吸收
;③如何判断X已完全分解?
连续两次加热、鼓气、冷却、称量甲装置的质量,
连续两次加热、鼓气、冷却、称量甲装置的质量,
;质量差不超过0.1g
质量差不超过0.1g
.④更精确的测定得出如下数据:X受热后完全分解,固体由16.52g变为12.00g,装置乙增重1.44g.写出X的化学式
7CuCO3?8Cu(OH)2或Cu15(OH)16(CO3)7或15CuO?7CO2?8H2O
7CuCO3?8Cu(OH)2或Cu15(OH)16(CO3)7或15CuO?7CO2?8H2O
.请写出X与盐酸反应的化学方程式为:
7CuCO3?8Cu(OH)2+30HCl=15CuCl2+7CO2↑+23H2O
7CuCO3?8Cu(OH)2+30HCl=15CuCl2+7CO2↑+23H2O
.(4)L是由3种元素构成的分子,能与I以1:2的物质的量之比反应生成尿素CO(NH2)2和物质M,其中M能使硝酸酸化的硝酸银溶液产生白色沉淀,写出L的电子式


